Определяне на моларната маса на метални еквиваленти по метода на водородното изместване
Цел на работата: запознаване с метода за определяне на моларната маса на метални еквиваленти.
Теоретично въведение
Дайте закона за еквивалентите, понятията за еквивалент, число на еквивалентност, фактор на еквивалентност, количество еквиваленти на веществото, моларна маса на еквиваленти, моларен обем на еквиваленти, формули за определяне на моларната маса на еквиваленти на просто вещество, бинарни съединения, киселини, основи и соли. Дай примери.
Експериментално
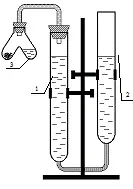
Използваният за целта уред - евдиометър се състои от две бюрети 1 (измервателна) и 2 (разширителна), частично напълнени с вода. Бюретите са монтирани на триножник, свързани с гумена тръба и образуват два съобщаващи се съда. Бюрета 1 е затворена с тапа с изпускателна тръба за газ, към която е прикрепена V-образна епруветка 3 (тръба на Оствалд).
Първо трябва да определите стойността на делението на измервателната бюрета. Числата на бюретата показват обема в кубични сантиметри. Отчитането на бюретката се извършва по долния менискус на течността, като нивото на течността и окото на наблюдателя трябва да са на една и съща хоризонтална линия.
Преди да започнете експеримента, е необходимо да проверите устройството за течове. За да направите това, прикрепете тръба на Оствалд към измервателната бюрета и създайте вакуум, като спуснете разширителната бюрета на 10–20 cm спрямо измервателната бюрета. Ако устройството е херметично затворено, нивото на течността в измервателната бюрета ще спадне леко поради вакуума и след това ще остане непроменено. В противен случай течността в бюрети 1 и 2 ще бъде на същото ниво. продължиопит на такова устройство е невъзможно; трябва да се свържете с вашия учител или инженер.
Без да прикрепяте тръбата на Оствалд, преместете разширителната бюрета и настройте нивото на течността в измервателната бюрета на нула или малко по-ниско.
Поставете проба метал в единия крак на епруветката на Оствалд (въведете масата на метала в таблица 2.1) и налейте солна киселина от една трета до половината от обема в другия крак. Прикрепете тръбата на Оствалд към бюрета 1. Проверете отново инструмента за течове. Регулирайте налягането в измервателната бюрета до атмосферното налягане. За да направите това, настройте течността в бюретите на същото ниво, но не по-високо от нулевото деление на измервателната бюрета. Измерете началния обем газ в бюрета 1 (V1). Внимателно накланяйки епруветката на Оствалд, изсипете киселината върху метала. Ще настъпи реакция с отделяне на водород. В края на реакцията, върнете налягането в измервателната бюрета обратно до атмосферното налягане, като настроите течността в бюретите на същото ниво. Измерете крайния обем газ в бюрета 1 (V2). Въведете томовете V1 и V2 в таблицата. 2.1.
Поставете използваната туба в мивката. Нулирайте еудиометъра.
Измерете лабораторната температура и атмосферното налягане. Въведете резултатите в табл. 2.1.
Изчисления
1. Определете обема на отделения водород, като използвате формулата
.
2. Определете парциалното налягане на водорода от
,
където p е атмосферното налягане; - парциално налягане на водната пара при температурата на експеримента (виж Приложение 2).
3. Намерете масата на освободения водород, като използвате уравнението на Менделеев-Клапейрон:
→ .
(Прехвърлете всички стойности за изчисление в една система от единици!)
4. Намерете експерименталната моларна маса на еквивалента на метала съгласно уравнението на закона на еквивалентите
.
5. Намерете стойността на експерименталната моларна маса на метала по формулата
.
6. Използвайки периодичната таблица, определете стойността
стойността на истинската моларна маса на метала и изчислете стойността на истинската моларна маса на металните еквиваленти:
7. Изчислете относителната грешка на експеримента по формулата
.
8. Всички експериментални и изчислени резултати са обобщени в таблица 2.1.
Таблица 2.1.Експериментални и изчислени резултати
| Не. | Име на стойността | Обозначаване | Единици | Числова стойност | SI единици | Числова стойност в SI |
| Маса на метала | м | Ж | килограма | |||
| Първоначален обем | V1 | мл | м 3 | |||
| Краен обем | V2 | мл | м 3 | |||
| Обем на водород | мл | м 3 | ||||
| температура | T | относно C | ДА СЕ | |||
| налягане | стр | mm Hg | татко | |||
| Парциално налягане на водните пари | mm Hg | татко | ||||
| Парциално налягане на водорода | mm Hg | татко | ||||
| Маса на водорода | Ж | килограма | ||||
| Експериментална моларна маса на метални еквиваленти | g/mol | kg/mol | ||||
| Истинската моларна маса на металните еквиваленти | g/mol | kg/mol | ||||
| Относителна грешка на опита | δ | % | % |
Заключения. Посочете възможните източници на експериментална грешка.
Тестови въпроси
1. Определете обема на отделения водород при
при нормални условия съгласно формулата на закона за комбинирания газ
,
където горният индекс (o) означава стойността, съответстваща на нормални условия.
2. Изчислете стойността на експерименталната моларна маса на металните еквиваленти, като използвате уравнението на закона за еквивалентите и моларния обем на водородните еквиваленти. Сравнете получената стойност на моларната маса на металните еквиваленти и предварително намерената.