Пептидни и протеинови хормони, Тиротропин, Инсулин - Хидрофилни хормони, тяхната структура и
Пептидни и протеинови хормони
Сега са известни няколко десетки естествени пептидни хормони и техният списък постепенно се попълва.
Благодарение на широкото използване на методите на бързо развиващата се протеинова химия през последните години, редица пептидни хормони са получени в хомогенно състояние, техният аминокиселинен състав е изследван, първичните (а в случай на протеинови хормони, вторични, третични и кватернерни) структури са идентифицирани и някои от тях са получени синтетично. Освен това големият напредък в областта на химическия синтез на пептиди направи възможно изкуственото получаване на много пептиди, които са изомери или аналози на естествени пептиди. Изследването на хормоналната активност на последните донесе изключително важна информация за връзката между структурата на пептидните хормони и тяхната функция.
Най-важните пептидни хормони са тиреотропин, инсулин, глюкагон, гастрин, окситоцин, вазопресин.
Тиротропин
По този начин тиротропинът стимулира дейността на щитовидната жлеза. От своя страна секрецията на тиреотропин се регулира на принципа на обратната връзка от хормоните на щитовидната жлеза. Следователно дейността на двете споменати ендокринни жлези е фино координирана.
Въвеждането на тиротропин предизвиква многократни промени в метаболизма: след 15-20 минути се увеличава секрецията на хормони на щитовидната жлеза и се увеличава усвояването на йод, който е необходим за синтеза на тези хормони; усвояването на кислород от щитовидната жлеза се увеличава, окислението на глюкозата се увеличава, метаболизмът на фосфолипидите и неоплазмата на РНК се активират. Сега е установено, че механизмът на действие на тиротропина, подобно на много други пептидни хормони, се свежда до активирането на аденилат циклаза, разположена в непосредствена близост до рецепторния протеин, с койтосвързва тиреотропина. В резултат на това в щитовидната жлеза се ускоряват редица процеси, включително биосинтезата на тиреоидни хормони.<3][7>
Инсулин - протеин, произвеждан в бета клетките на панкреаса. Структурата му е подробно проучена. Инсулинът е първият протеин, чиято първична структура е изяснена от F. Sanger. Той е първият протеин, получен чрез химичен синтез.
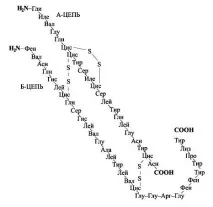
За първи път присъствието в жлезата на хормон, който влияе върху метаболизма на въглехидратите, е отбелязано от Меринг и О. Минковски (1889). По-късно Л.В. Соболев (1901) установява, че източникът на инсулин в панкреаса е неговата островна част, във връзка с което през 1909 г. този хормон, който все още не е индивидуализиран, получава името инсулин (от латинскиinsula- остров). През 1992 г. F. Banting и G. Best приготвят за първи път активен препарат на инсулин, а до 1926 г. са разработени методи за неговото изолиране във високо пречистено състояние, включително под формата на кристални препарати, съдържащи 0,36% Zn.
Инсулинът се синтезира в бета-клетките на Лангерхансовите острови по нормалния механизъм на протеинов синтез. Транслацията на инсулина започва върху рибозомите, свързани с ендоплазмения ретикулум, с образуването на инсулинов препрохормон. Този първоначален препрохормон с молекулно тегло 11500 се разцепва в ендоплазмения ретикулум до проинсулин с молекулно тегло около 9000. Освен това, в апарата на Голджи, по-голямата част от него се разгражда на инсулин, който е опакован в секреторни гранули, и пептиден фрагмент. Но почти 1/6 от крайния секретиран продукт остава под формата на проинсулин. Проинсулинът е неактивна форма на хормона.
Молекулното тегло на кристалния инсулин е 36 000. Неговата молекула е мултимер, съставен от шестпротомери и два Zn атома. Протомерите образуват димери, които взаимодействат с имидазоловите ядра наhis10радикалите на В веригата и подпомагат тяхното агрегиране в хексамер. Разпадайки се, мултимерът дава три субчастици с молекулно тегло 12 000 всяка. От своя страна всяка субчастица се разделя на две равни части с М = 6000. Всички изброени модификации на инсулина - протомер, дамер и хексамер - имат пълна хормонална активност. Следователно, инсулиновата молекула често се идентифицира с протомер с пълна биологична активност (М = 6000), особено след като при физиологични условия инсулинът съществува в мономерна форма. По-нататъшното фрагментиране на инсулиновата молекула (с М = 6000) във верига А (от 21 аминокиселинни остатъка) и верига В (от 30 аминокиселинни остатъка) води до загуба на хормонални свойства.
Въвеждането на инсулин чрез инжектиране или перорално (в устата) под формата на лекарство, капсулирано в липозоми, предизвиква обратен ефект: намаляване на кръвната захар, увеличаване на запасите от мускулен гликоген, повишаване на анаболните процеси, нормализиране на минералния метаболизъм и др. Всички горепосочени явления са резултат от промяна под влиянието на инсулиновата пропускливост за глюкозата на клетъчните мембрани, на повърхността на които се откриват Са2+-зависими инсулинови рецептори с висок и нисък афинитет. Повишавайки нивото на проникване на глюкозата в клетката и субклетъчните частици, инсулинът увеличава възможностите за нейното използване в определени тъкани, независимо дали става дума за биосинтеза на гликоген от него или неговото дихотомно или апотомно разграждане.
Когато инсулинът взаимодейства с рецептора на клетъчната мембрана, активността на протеин киназния домен на инсулиновия рецептор се възбужда, което засяга вътреклетъчния метаболизъм на въглехидрати, липиди и протеини. Заинсулинът няма типичен аденилатциклазен механизъм на действие.[3] [7]