Примери за решаване на типични задачи - Урок 8 - Смеси от вещества
РАЗДЕЛ I. ОБЩА ХИМИЯ
6. Смеси от вещества. Решения
Примери за решаване на типични проблеми
Задача 1. Изчислете масовата част на калиев хидроксид (%) в разтвор, получен чрез разтваряне на 0,75 mol калиев оксид в 180 ml вода.
1. Съставете уравнението на реакцията и, като направите пропорция, изчислете количеството алкално вещество n (KOH), което се образува:
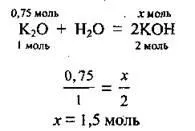
2. Според формулата изчисляваме масата на образуваната основа. M (KOH) \u003d 56 g / mol:
3. За да се намери масата на разтвора, е необходимо да се определят масите на K2 O и водата. М(K2 O) = 94 g/mol, ρ(Н2 O) = 1 g/ml:
4. Изчислете масата на разтвора:
5. Според формулата изчисляваме масовата част на алкалите в получения разтвор:
Отговор: w (KOH) = 33,5%.
Задача 2. В 39,6 ml вода се разтварят 0,2 mol серен (V I) оксид. Посочете количеството вода и в получения разтвор.
1. Изчислете масата на водата, в която е разтворен SO 3:
2. Серният (V) оксид е киселинен оксид, следователно, когато се разтвори във вода, се образува сулфатна киселина. Съгласно уравнението на реакцията, ние изчисляваме количеството водно вещество n 1 (H2 O), което е химически свързано със SO 3:
3. Изчислете масата на тази химически свързана вода (M (H2 O) \u003d 18 g / mol):
4. Намерете масата на водата m 2 (H2 O), която остава в разтвора:
5. Изчислете количеството водно вещество:
Задача 3. 35,2 g смес от мед и желязо се поставят в излишък от разтвор на сярна киселина. Изпуснати са 8,96 литра газ. Изчислете масовата част на медта (%) в сместа.
Медта не взаимодейства, тъй като се намира във витискувалния ред от метали вдясно от водорода:
Само желязото реагира с разредена сярна киселина. Съгласно уравнението на реакцията изчисляваме масата на желязото в сместа (VM = 22,4 l / mol):
1. Според уравнението на реакциятанаправете пропорция и изчислете масата на желязото m ( Fe ):
2. Определете масата на медта в смес от метали:
3. Изчислете масовата част на медта в сместа:
Отговор: w( С u ) = 36,4%.
Задача 4. 219 g солна киселина с масова част на хлороводород 0,2 бяха изразходвани за разтваряне на 37,8 g смес от алуминий и сребро. Изчислете масата на среброто в сместа.
Среброто не взаимодейства с перхлорната киселина, тъй като се намира вдясно от водорода във витискувалната серия от метали, само алуминият реагира с киселина:
1. Изчислете масата на хлороводорода в киселина:
2. Съгласно уравнението на реакцията Нека направим пропорция и изчислим масата на алуминия (M (HC l) \u003d 36,5 g / mol):
3. Изчислете масата на среброто в първоначалната смес:
Отговор: m ( Ag ) \u003d 21 тона.
Задача 5. Посочете обема вода, който трябва да се добави към 200 g разтвор на калиев сулфат с масова част на солта 20%, за да се получи разтвор, в който масовата част на солта е 12,5%
1. Изчислете масата на солта в 200 g от първоначалния разтвор:
2. Означаваме масата на добавената вода като x g, тогава масата на разтвора ще бъде:
и масата на солта остава непроменена:
3. Заменете всички известни стойности във формулата за изчисляване на масовата част и изчислете масата на добавената вода x:
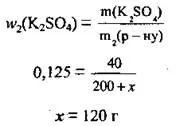
4. Използвайки формулата, изчисляваме обема на използваната вода. ρ(Н2О) = 1 g/ml:
Отговор: V (H 2 O) \u003d 120 ml.
Задача 6. В 300 g разтвор на C u C l 2 с масова част от солта 15% се разтваря 0,08 mol купрум (II) хлорид. Изчислете масовата част на купрум(II) хлорид в получения разтвор.
1. Изчислете масата на солта в 300 g разтвор:
2. Определете масата на 0,08 mol CuCl 2. M (C u C l 2) \u003d 135 g / mol:
3. Изчислете общата маса на солта в получения разтвор:
4. Намерете масата на получения разтвор:
5.Изчислете масовата част на солта:
Отговор: w 2 ( С u С l 2 ) = 18%.
Задача 7. 0,2 mol купрум(II) сулфат пентахидрат се разтварят в 300 g вода. Изчислете масовата част на купрум(II) сулфат (%) в този разтвор.
1. Когато кристален хидрат се разтвори във вода, водата от кристализацията преминава в разтвор:
и количеството медно (II) сулфатно вещество, както се вижда от уравнението, остава непроменено и съвпада с количеството кристално хидратно вещество:
2. Изчислете масите на кристален хидрат и купрум(II) сулфат, като използвате формулата. M ( CuSO 4 ) \u003d 160 g / mol, M ( CuSO 4 5H2 O ) = 250 g / mol:
3. Изчислете масата на разтвора:
4. Определете масовата част на купрум ( II ) сулфат в разтвор:
Отговор: w (CuSO 4 ) = 9,1%.
Задача 8. Каква маса бромна вода с масова част на брома 15% трябва да се използва за реакцията с 13,44 литра смес от етан и етен, в която обемната част на етан е 66,67%?
1. Изчислете обема на етан в сместа по формулата:
2. Само етен реагира с бромна вода и затова изчисляваме неговия обем:
3. Да запишем уравненията; реакции на етена с бромна вода, ще направим пропорция и ще изчислим масата на брома. M (B r 2 ) \u003d 160 g / mol, VM \u003d 22,4 l / mol:
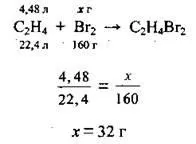
4. Според формулата изчисляваме масата на бромната вода:
Отговор: m (p-on Br 2) \u003d 213.1 3 g.
Задача 9. Определете масата на ферум (II) сулфат хептахидрат, който трябва да се използва за получаване на 304 g разтвор с масова част на ферум (II) сулфат 10%.
1. Според формулата изчисляваме масата на солта в разтвора:
2. Когато се разтвори във вода, кристалният хидрат се разрушава:
Използвайки формулата, изчисляваме количеството солно вещество. M (FeS О 4 ) = 152 g/mol:
3. Определете масата на ферум(II) сулфат хептахидрат. M (FeS В 4 7Н2О) = 278 g/mol:
Отговор: m ( FeS В4 7Н2О) =55,6 g.
Задача 10. За пълното неутрализиране на 49 g разтвор на сярна киселина са изразходвани 200 g разтвор на калиев хидроксид с масова част на основа 5,6%. Изчислете масовата част на киселината (%) в разтвора.
1. Според формулата изчисляваме масата на калиев хидроксид в алкален разтвор:
2. Нека да напишем уравнението на реакцията и да направим пропорция и да извършим изчисления, за да намерим масата на сярната киселина в разтвора. M ( H 2 S O 4 ) \u003d 98 g / mol, M (KOH) \u003d 56 g / mol:
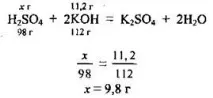
3. Според формулата изчисляваме масовата част на киселината в разтвора: