Природата на оксидите и хидроксидите от групи I-VII
Хидроксиди, тяхната природа
химическа връзка
Видът на химичната връзка зависи от електроотрицателността на съставните й елементи.
Образува се по време на взаимодействието на атоми на елементи, които рязко се различават един от друг в стойностите на електроотрицателността (Me + HeMe).
Свойства: ненасочени, ненасищаеми.
Съединения: твърди, ниско летливи, огнеупорни вещества (типични метални халиди, основи, метални хидриди).
Възниква в резултат на образуването на общи електронни двойки (HeMe + NeMe).
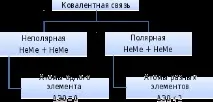
Съединения (неполярна ковалентна връзка): газообразни, твърди, по-рядко течни вещества (O2, Cl2, Br2, I2, диамант, графит, сяра).
Съединения (полярна ковалентна връзка): течни и газообразни вещества (HCl, H2O, NH3, киселинни оксиди, киселини).
Образува се в резултат на взаимодействието на относително свободни електрони с метални йони.
Съединения: твърди вещества (всички Ме с изключение на живак).
Образува се между водороден атом, свързан с атом на електроотрицателен елемент от една молекула и атом на силно електроотрицателен елемент от друга молекула.
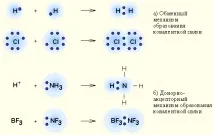
Механизми за образуване на ковалентна връзка
Методи за припокриващи се електронни облаци
("a, b, c" - σ-тип, "d" - π-тип)
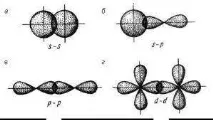
σ-връзкае ковалентна връзка, образувана от припокриващи се атомни орбитали по протежение на линия, свързваща центровете на атомите (силна връзка).
π-връзкае ковалентна връзка, образувана от припокриването на атомни орбитали извън линията, свързваща ядрата на атомите (слаба връзка).
Свойства на ковалентната връзка
Дължината на връзката (l)е разстоянието между ядрата на атомите, образуващи връзката.
Енергия на свързване (Ew)–е енергията, необходима за разкъсване на връзката, измерена в kJ/mol.
Колкото по-голямо е припокриването на атомните орбитали, толкова по-голяма е енергията на свързване, толкова по-силна е химичната връзка.
Редът (множеството) на връзкатае броят на електронните двойки, участващи в образуването на връзката.
Тройна връзка (σ+π+π)
Двойна връзка (σ+π)
Единична връзка (σ)
Колкото по-голяма е кратността на връзката, толкова по-голяма е силата (енергията) на връзката, толкова по-къса е нейната дължина.
Наситеносте способността на атомите да образуват определен брой ковалентни връзки.
Ориентацията на връзкатаопределя пространствената структура на молекулите, т.е. тяхната геометрия.
Полярността на връзкатахарактеризира степента на изместване на общата електронна двойка към по-електроотрицателен атом.
Поляризуемостта на ковалентната връзкае способността на молекулите да променят своята полярност под въздействието на външно електрическо поле.
Хибридизацията на електронните орбиталие процесът на взаимодействие на атомни орбитали с различни форми и различни енергии, което води до образуването на хибридни орбитали, които са еднакви по форма и енергия.
Броят на хибридните орбитали е равен на броя на оригиналните орбитали!
Типът на хибридизациятаелектронните орбиталиопределя пространствената конфигурация на молекулата.