Redox Titration Lab #14 Стандартизация на разтвора
Целта на работата: да се установи точната концентрация на разтвора KMnO4.
Същността на работата.Точната концентрация на разтвора на калиев перманганат се определя 8-10 дни след приготвянето му с помощта на оксалова киселина H2C2O4 ∙ 2H2O или натриев оксалат Na2C2O4 и други вещества. През това време настъпва окисление на редуциращите агенти, присъстващи в дестилираната вода (прах, следи от органични съединения), и концентрацията на KMnO4 се стабилизира.
Натриевият оксалат и оксаловата киселина са най-удобните втвърдяващи агенти, защото са нетоксични и стабилни при съхранение.
Титруването се основава на реакцията
Коефициентите на еквивалентност на перманганат и оксалат се определят въз основа на полуреакциите:
fequiv(MnO4 – ) =
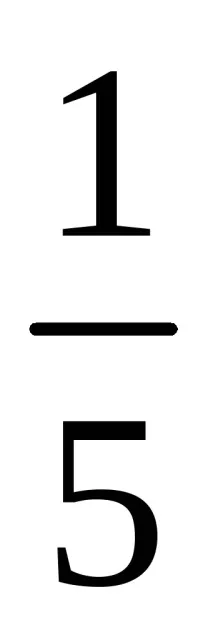
feq(
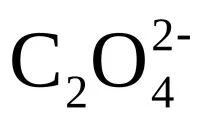
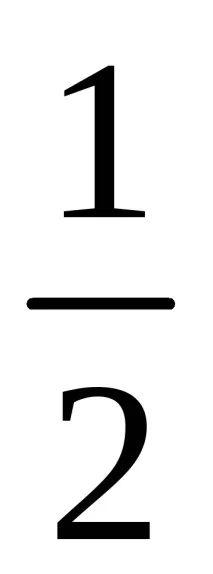
Титруването на оксалатни йони с калиев перманганат се извършва всилно кисела средапоради следните причини:
- образуват се безцветни Mn 2+ йони, които не пречат на фиксирането на крайната точка на титруването;
- окислителната способност на KMnO4 в кисела среда е много по-висока, отколкото в неутрална и леко алкална среда:
Средата се създава от излишък на H2SO4. HNO3 и HCl не трябва да се използват, тъй като при тях възникват странични реакции.
Реакцията на взаимодействие на калиев перманганат с оксалатни йони принадлежи къмавтокаталитичен тип.Катализира се от реакционния продукт - Mn 2+ йони. Първите капки KMnO4, дори и в горещ разтвор, се обезцветяват много бавно. По време на титруването концентрацията на Mn 2+ йони се увеличава и скоростта на реакцията се увеличава.Нагряванетона титрувания разтвор увеличава скоростта на реакцията. Освен това при нагряванестойността на скока на титруване се увеличава, следователно точността на определянето се увеличава.
Титруването се извършвабез индикатор, тъй като всички реакционни продукти са безцветни и една допълнителна капка KMnO4 след точката на еквивалентност ще даде на разтвора собствен пурпурен цвят.
Оборудване и реактиви: бюрета, пипета на Мор, конични колби, мерителна колба, мерителен цилиндър (10–25 ml), котлон,
Извършване на работата.Част от втвърдяващото вещество, изчислена за приготвяне на 0,05 N. разтворът се претегля в тигел на техническа везна, след това масата се определя на аналитична везна и веществото се прехвърля без загуба в мерителна колба.
Тигелът с остатъците от веществото се претегля на същата аналитична везна и по разликата се определя масата на регулиращото вещество. Разтворете пробата в дестилирана вода, разредете разтвора до марката и разбъркайте добре. Познавайки точната маса на веществото и капацитета на мерителната колба, изчислете моларната концентрация на еквивалента на оксалатни йони в разтвора.
Напълнете бюретата с разтвор KMnO4 и настройте нивото на течността на нула. Препоръчително е да се отчитат обемите по време на титруване с калиев перманганат по горния ръб на менискуса на нивото на течността, тъй като долният ръб на менискуса не се вижда поради интензивния цвят на разтвора.
В конична колба за титруване се поставят 10 ml 2N. разтвор на H2SO4 и се нагрява,като се избягва кипене. С пипета се взема аликвотна част от разтвора на коригиращото вещество от мерителната колба и се добавя към загрятия разтвор на сярна киселина (киселинните разтвори на оксалати не трябва да се нагряват и кипят, тъй като се разлагат). Горещият разтвор се титрува на капки с калиев перманганат при енергично разбъркване. Всяка следваща капка се добавя едва след изчезването на цвета от предишната. Титрува сеперманганат, докато бледо розов цвят не изчезне за 30 секунди.
Въз основа на резултатите от титруването се изчислява точната концентрация на разтвора на калиев перманганат, mol-eq / l.
В някои случаи, по указание на учителя, може да се приготви разтвор на KMnO4 от фиксанал или определянето на концентрацията на KMnO4 може да се извърши с помощта на оксалатен разтвор, приготвен от фиксанал.
С помощта на софтуера "Работилна среща по AH и FHMA":
оценява неопределеността на измерването;
извършване наQ-тест и статистическа обработка на резултатите от анализа, ако има 4 или повече резултата от паралелни измервания.