Rehcjdfz gj bvbb
Опишете методите за получаване на веществата, посочени в параграфи (А), структурата на техните молекули, физични и химични свойства, приложение. Илюстрирайте отговора си с уравнения на реакцията.
А) Дициан, циановодородна киселина, цианиди, тиоцианати.
B) Как може да се извърши следната трансформация
[Fe(CN)4] 4- [Fe(CN)6] 3-
Производство: Цианидът се произвежда в голям мащаб чрез каталитични методи. окисляване на HCN при 200-400 °C O2 въздух или NO2. В малки количества дицианът става топлинен. разлагане на Ag и Hg цианиди или чрез действие на Cu соли върху цианиди:
2KCN + CuSO42CuCN + 2K2SO4 + (CN)2
Други начини за получаване на дициан:
Физични свойства: Молекулярният цианид е линеен; дължина на връзката C - C 0,1368 nm, 0,1157 nm C2N2 - безцветен газ с остра миризма, т.т. -27,8 ° C; tкип. -21,15 °C; горими Във въздуха понякога се запалва спонтанно.
Химични свойства: Според химичните си свойства цианогенът отчасти прилича на халогени (оттук и името „псевдохалоген“), например C2N2 взаимодейства с водни разтвори на алкали подобно на хлора:
Умерено разтворим във вода, за предпочитане валкохол,етер,оцетна киселинаОбразува комплексни съединения с метали, например. (CN)2 x 2CuCl, с Гринярд - нитрили:
(CN)2 + RMgHalRCN + Mg(CN)Hal
Приложение:През 1824 г. немският химикФридрих Вьолерполучаваоксалова киселина от диацин и вода.:
(CN)2H2O> (COOH)2 (оксалова киселина)
Цианоген,Цианоген бромидиЦианоген хлоридсе използват в органичния синтез. diian се използва също като фумигант и горивен газ за заваряване и рязане на огнеупорни метали. Той е главнияткомпонент на ракетно гориво, смесен с озон или флуор, и може също да присъства в газове, отделяни от доменна пещ. Цианогенният бромид се използва за обработка на тъкани, като фумигант и пестицид, в процеса на добив на злато. Цианогенният хлорид служи като добавка към фумигантите.
Синила (циановодородна) киселина
Получаване-Понастоящем има три най-разпространени метода за производство на циановодородна киселина в индустриален мащаб:
Метод на Андрусов: директен синтез отамонякиметанв присъствието на въздух иплатиненкатализаторпри висока температура:
BMA (Blausäure aus Methan und Ammoniak)метод, патентован отDegussa: директен синтез отамонякиметанв присъствието на платинов катализатор при висока температура:
Страничен продукт при производството наакрилонитрилчрез окислителна амонолиза на пропилей.
Физични свойства-(циановодород, нитрилна мравчена киселина) HCN, безцветен. подвижна течност с мирис на горчиви бадеми Молекулата е линейна, дължината на C-H връзката е 0,1064 nm, C = N 0,1156 nm, 9,92 10 -30 C m (газ); т.т. -13,29°C, т.к 25,65°С; Съществува в два кристала. модификации: отдолу - 102,78 ° C - в ромбичен (a = 0,413 nm, b = 0,485 nm, c = 0,434 nm, z = 2, пространствена група I2mm), над това t-ry - в тетрагонален (a = 0,463 nm, c = 0,434 nm, z = 2, пространствена група I4mm). В течна форма и в разтвор той образува линейни асоциати поради водородни връзкиN. N. Циановодородната киселина е запалима и експлозивна. Силно токсичен.
Химични свойства-Молекулата HCN е силно полярна (μ = 0,96·10 −29 C·m).
Безводният циановодород е силнойонизиращразтворител,Електролитите, разтворени в него,се разпадатдобре на йони. Неговата относителнадиелектрична константапри 25 °C е 107 (по-висока от тази навода). Това се дължи на линейното свързване на полярните HCN молекули поради образуването наводородни връзки.
МногослабаедноосновнакиселинаK = 1,32 10 −9 (18 ° C). Образува сметалисоли -цианиди. Реагира соксидиихидроксидиалкалнииалкалоземниметали.
Парите на циановодородната киселина горят във въздуха с виолетов пламък, образувайки H2O, CO2 и N2. В смес откислородсфлуортой гори с отделяне на голямо количество топлина:
kJ.
Лесно полимеризира в присъствието набаза(често с експлозия). Образуваадукти, например HCN-CuCl
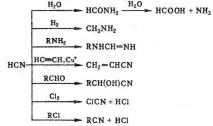
Приложение:Циановодородната киселина се използва при производството на цианиди, цианхлорид, акрилонитрил, адипонитрил, акрилати, аминокиселини, хидроксинитрили, като фумигант. Циановодородната киселина е основната съставка на Zyklon B, който е бил използван от нацистите по време на Втората световна война за убиване на хора в концентрационните лагери. В някои американски щати циановодородната киселина е била използвана в газови камери като отрова при изпълнението на смъртни присъди, последно в Аризона през 1999 г. [4] Смъртта обикновено настъпва в рамките на 5-15 минути.
Получаване:Основният метод за получаване на цианиди на алкални метали е взаимодействието на съответния хидроксид с циановодородна киселина, по-специално това е основният промишлен метод за получаване на най-големия тонажен цианид -натриев цианид. Друг промишлен метод за получаване на натриев цианид е сливането нацианамидкалцийс въглища инатриев хлоридилисода:
CaCN2 + C + 2 NaCl 2 NaCN + CaCl2
Образуваната в процеса стопилка („цианид“, „черен цианид“) съдържа 40-47% цианиди по отношение на NaCN и се използва за цианиране на стомана , а също така се използва като суровина за производството на натриев цианид, калий, а също ижълта кръвна сол.
Други цианиди се получават главно чрезобменни реакциина цианиди на алкални метали със съответните соли.
цианиди на алкални металимогат също да бъдат получени чрез взаимодействие на метала сдицианин:
N≡C-C≡N + 2Na 2NaCN
или оттиоцианатичрез нагряването им в присъствието нажелязона прах:
KSCN + Fe KCN + FeS
Физични и химични свойства-ЦИАНИДИ, неорган. съединения, съдържащи CN групата. Разграничаване на прости цианиди - солицианова киселина HCN и някои други и сложни. По естеството на хим. връзките между елемента и йона CN се разделят на йонни, ковалентни и координационни. Наречени цианиди. също псевдохалогениди. орг. съединения, съдържащи CN групата, образуват две серии от производни - нитрили и изонитрили. Амониеви цианиди, алкални и алкалоземни метали - йонни съединения, добре разтворени. вход, разтвор на NaCN и NH4CN. в етанол. При повишена t-re цианидите на алкалните и алкалоземните метали се хидролизират напълно. Водните разтвори на цианидите поради хидролиза имат силно основно р-ция. Цианидите на алкалните метали MeCN и алкалоземните метали Me (CN) 2 (където Me е метал) са термично стабилни и се хидролизират във водни разтвори. Цианидите на тежките метали са термично нестабилни; във вода, с изключение на Hg (CN) 2, те са неразтворими. Цианидите се окисляват до образуване на цианати (например 2KCN + O2 = 2KOCN). Много метали под действието на излишък от калиев цианид или цианиднатрият дава сложни съединения, които се използват например за извличане на злато и сребро от руди (виж Цианидиране):
Златото и среброто се изолират от разтвора чрез електролитно отлагане или чрез действието на метален цинк. При нагряване във водни разтвори на йонни цианиди се хидролизира до формиат и амоняк:
NaCN + 2 H2O HCOONa + NH3
Под действието на леки окислители (включително във въздуха) цианидите на алкалните метали лесно се окисляват доцианати:
NaCN + [O]NaNCO
Приложение:Цианидите се използват за извличане назлатоисреброотрудичрез метода нацианидиране(един отхидрометалургичнитепроцеси, базирани на разтварянето на метала в цианидни разтвори поради образуването накомплексни соли).
Велектрохимията- катокомплексообразуващ агентс високаконстанта на стабилностза приготвяне на електролити загалванопластикапокриване наблагородни металина продукти (златно покритие,сребърно покритие),
Ворганичен синтез.
Цианидите се използват ваналитичната химияза разделяне на метали (катокомплексообразуващ агент).
Подобно нафероцианидите, цианидите някога са били използвани заазотиране на стомана.
Те са използвани катоотрови, включително като отрова от мишки и плъхове, циановодородната киселина и някои от нейните производни (цианоген хлорид) също са използвани като военниотровни агенти.
-Като фиксатор при мокър фотопроцес.
Получаване:методи за получаване на HNCS-intermod. RNCS с KHSO4 или йонообменни водни разтвори NH4NCS. Родан (тиоцианат) обикновено се получава според областите:
Алкални метали и амониеви тиоцианати се получават чрез улавяне на цианидни съединения,съдържащи се в коксовия газ, разтвори на съответните полисулфиди. В допълнение, NH4NCS получават взаимодействие. NH3 с CS2, KNCS и NaNCS синтез на KCN или NaCN със сяра. Други тиоцианати се синтезират чрез обмен на р-ция на сулфати, нитрати или метални халиди с тиоцианат на амибарий, K или Na, взаимодействие на метални хидроксиди или карбонати с HNCS.
Физични и химични свойства-Тиоцианат (хидроген тиоцианат) HNCS - жълтеникава течност, т.т. -110°C; дължини на връзката (nm) 0.09887 (H-), 0.21164 (N-C) и 0.15605 (C-S), ъгъл HNC 134.98°. Във водни разтвори (стабилни при концентрация на HNCS по-малко от 5%), той е силно дисоцииран (pKa 0,85 при 18 ° C), в конц. p-pax се разлага с образуването на т.нар. ксантен водород (f-la I) и други продукти:
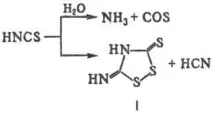
Наиб. характерни р-ции-окисление, редукция, халогениране, както и обмен на р-ции с други тиоцианати, например:
KNCS + Fe : KCN + FeS
NaNCS + Zn + HC1 : CH3NH2 HC1 + NaCl + ZnCl2
Тиоцианатите образуват комплексни съединения, в които металът, в зависимост от донорно-акцепторния sv-лиганд, може да бъде координиран както от N атом, така и от S атом. Алкалните метали и амониевите тиоцианати се разлагат при натрий, напр.:
Термичен Изомеризацията на NH4NCS е основа за пром. получаване на тиокарбамид:
Приложение:Тиоцианатите се използват в производството на тиокарбамид, като реагенти за боядисване и щамповане на тъкани, компоненти на проявители във фотографията, аналитични реактиви в роданометрията и живака, за приготвяне на предачни разтвори в производството на акрилни влакна, за получаване на орг. тиоцианати, като стабилизатори на пламъка при производството на експлозиви, инсектициди и фунгициди. Тиоцианатните комплекси се използват във фотометрията. анализ за определяне на Co, Fe, Bi, Mo, W, Re, в технологията на редки метали за разделянеZr и Hf, Th и Ti, Ga и Al, Ta и Nb, Th и La, за да се получи спектрално чист La. Тиоцианати Nb(V) и Ta(V)-катализатори на p-цията на Friedel-Crafts. Вижте също Амониев тиоцианат, Натриев тиоцианат.
Brotherton T.K., Lynn J.W., Синтезът и химията на цианогена, "Химически прегледи", 1959 г.
Карапетянц М. Х. Дракин С. И. Обща и неорганична химия. - М.: Химия, 1994.
Бобков С.С., Смирнов С.К., Циановодородна киселина, М. 970 гр
Смирнов С.К., Химия на псевдохалогенидите, К., 1981 г.
Соловьов С.Н., Началото на химията. Химия на елементите и техните съединения (част 1), М., 2011 г.