Структурата на мускулното влакно и неговото съкращение
Мускулната контракция в живата система е механохимичен процес. Съвременната наука го смята за най-съвършената форма на биологична мобилност. Биологичните обекти „разработиха“ свиването на мускулните влакна като начин за придвижване в пространството (което значително разшири възможностите им за живот).
Мускулната контракция се предшества от фаза на напрежение, която е резултат от работата, извършена чрез преобразуване на химическата енергия в механична енергия директно и с добра ефективност (30-50%). Натрупването на потенциална енергия във фазата на напрежение привежда мускула в състояние на възможно, но все още неосъществено свиване.
Животните и хората имат (и хората смятат, че вече са добре проучени)два основни вида мускули: набраздени и гладки.Набраздените мускули или скелетните мускули са прикрепени към костите (с изключение на набраздените влакна на сърдечния мускул, които се различават от скелетните мускули и по състав). Гладкитемускули поддържат тъканите на вътрешните органи и кожата и образуват мускулите на стените на кръвоносните съдове, както и на червата.
В биохимията на спорта се изучаватскелетните мускули, които са "конкретно отговорни" за спортните резултати.
Мускулът (като макроформация, принадлежаща на макрообект) се състои от отделнимускулни влакна (микроформации). Има хиляди от тях в мускула, съответно, мускулното усилие е интегрална стойност, която сумира контракциите на много отделни влакна. Има три типа мускулни влакна:бели бързо съкращаващи се,междинни ичервени бавни съкращаващи се. Видовете влакна се различават по механизма на тяхното енергоснабдяване и се контролират от различни моторни неврони. Типовете мускули се различават по отношение на видовете влакна.
Отделно мускулно влакно е нишковидно безклетъчно образувание -симпласт. Симпластът „не прилича на клетка“: има силно удължена форма с дължина от 0,1 до 2-3 cm, в мускула на сарториуса до 12 cm и дебелина от 0,01 до 0,2 mm. Симпластата е заобиколена от обвивка -сарколема, към повърхността на която се приближават окончанията на няколко моторни нерва. Сарколемата е двуслойна липопротеинова мембрана (с дебелина 10 nm), подсилена с мрежа от колагенови влакна. Когато се отпуснат след контракция, те връщат симпласта в първоначалната му форма (фиг. 4).
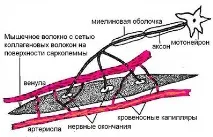
Ориз. 4. Отделно мускулно влакно.
На външната повърхност на сарколемма-мембраната потенциалът на електрическата мембрана винаги се поддържа, дори в покой е 90-100 mV. Наличието на потенциал е необходимо условие за управлението на мускулните влакна (като автомобилен акумулатор). Потенциалът се създава благодарение на активния (т.е. с цената на енергия - ATP) пренос на вещества през мембраната и нейната селективна пропускливост (според принципа - „Ще пусна или пусна когото си поискам“). Следователно вътре в симпласта някои йони и молекули се натрупват в по-висока концентрация, отколкото навън.
Сарколемата е добре пропусклива за K + йони - те се натрупват вътре, а Na + йони се отстраняват навън. Съответно концентрацията на Na + йони в междуклетъчната течност е по-голяма от концентрацията на K + йони вътре в симпласта. Изместването на pH към киселинната страна (например по време на образуването на млечна киселина) повишава пропускливостта на сарколемата за макромолекулни вещества (мастни киселини, протеини, полизахариди), които обикновено не преминават през нея. Веществата с ниско молекулно тегло (глюкоза, млечна и пирогроздена киселина, кетонови тела, аминокиселини, къси пептиди) лесно преминават (дифундират) през мембраната.
Вътрешното съдържание на симпласта -саркоплазма - представлява колоидна протеинова структура (наподобява желе по консистенция). В суспендирано състояние съдържа гликогенни включвания, мастни капки, различни субклетъчни частици са „вградени“ в него: ядра, митохондрии, миофибрили, рибозоми и др.
Съкратителният "механизъм" вътре в симпласта емиофибрилите. Това са тънки (Ø 1 - 2 микрона) мускулни нишки, дълги - почти равни на дължината на мускулното влакно. Установено е, че в симпластите на нетренираните мускули миофибрилите не са подредени по протежение на симпласта, а с разпръснати и отклонения, докато в тренираните миофибрилите са ориентирани по надлъжната ос и също са групирани в снопове като въжета. (При предене на изкуствени и синтетични влакна, полимерните макромолекули първоначално не са разположени строго по протежение на влакното и, подобно на спортистите, те са „упорито обучени“ - ориентирани правилно - по оста на влакната, чрез многократно пренавиване: вижте дългите работилници в ZIV и Химволокно).
В светлинен микроскоп може да се види, че миофибрилите наистина са "напречно ивици". Те редуват светли и тъмни зони - дискове. Тъмните дисковеA (анизотропни) съдържат повече протеин от светлите дисковеI (изотропни). Светлинните дискове се пресичат отZ мембрани (телофрагми) и областта на миофибрилата между двеZ -мембрани се наричасаркомер. Миофибрилата се състои от 1000 - 1200 саркомери (фиг. 5).
Свиването на мускулното влакно като цяло се състои от съкращения на единичнисаркомери Свивайки всеки поотделно, саркомерите заедно създават интегрална сила и извършват механична работа за свиване на мускула.
Дължината на саркомера варира от 1,8 µm в покой до 1,5 µm при умерена контракция и до 1 µm при пълна контракция.Дисковете на саркомерите, тъмни и светли, съдържат протофибрили (миофиламенти) - протеинови нишковидни структури. Те са два вида: дебели (Ø - 11 - 14 nm, дължина - 1500 nm) и тънки (Ø - 4 - 6 nm, дължина - 1000 nm).
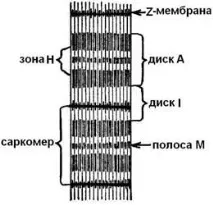
Ориз. 5. Парцел на миофибрила.
Светлите дискове (I ) се състоят само от тънки протофибрили, докато тъмните дискове (А)се състоят от два вида протофибрили: тънки, свързани помежду си с мембрана, и дебели, концентрирани в отделна зона (H ).
Когато саркомерът се свие, дължината на тъмния диск (A)не се променя, а дължината на светлия диск (I ) намалява, тъй като тънките протофибрили (на светлите дискове) се преместват в пролуките между дебелите (на тъмните дискове). На повърхността на протофибрилите има специални израстъци - сраствания (с дебелина около 3 nm). В "работно положение" те образуват зацепване (чрез напречни мостове) между дебели и тънки нишки от протофибрили (фиг. 6). КогатоZ -мембраните се свиват, те опират в краищата на дебелите протофибрили, а тънките протофибрили могат дори да се увиват около дебелите. По време на свръхконтракцията краищата на тънките нишки в центъра на саркомера се увиват, а краищата на дебелите протофибрили се смачкват.
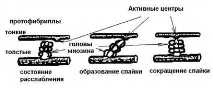
Ориз. 6. Образуване на шипове между актин и миозин.
Енергийното захранване на мускулните влакна се осъществява с помощта насаркоплазмен ретикулум (това също есаркоплазмен ретикулум ) - система от надлъжни и напречни тубули, мембрани, везикули, отделения.
В саркоплазмения ретикулум различни биохимични процеси протичат организирано и контролирано, мрежата обхваща всичко заедно и всяка миофибрила поотделно. Ретикулумът включва рибозоми, те извършват протеинов синтез, а митохондриите са "клетъчниелектроцентрали” (по дефиницията на училищен учебник). Всъщностмитохондриите са вградени между миофибрилите, което създава оптимални условия за енергийно захранване на процеса на мускулна контракция.Установено е, че броят на митохондриите в тренираните мускули е по-голям, отколкото в същите нетренирани.
Мускулна химия.
Водата с задържа 70 - 80% от теглото на мускула.
Катерици. Протеините съставляват 17 до 21% от мускулното тегло: приблизително 40% от всички мускулни протеини са концентрирани в миофибрилите, 30% в саркоплазмата, 14% в митохондриите, 15% в сарколемата, останалите в ядрата и други клетъчни органели.
Безазотни съединения. Мускулите съдържат въглехидрати, гликоген и неговите метаболитни продукти, както и мазнини, холестерол, кетонови тела и минерални соли. В зависимост от диетата и степента на тренировка, количеството гликоген варира от 0,2 до 3%, докато тренировките увеличават масата на свободния гликоген. Резервните мазнини в мускулите се натрупват по време на тренировка за издръжливост. Свързаните с протеин мазнини са приблизително 1%, а мембраните на мускулните влакна могат да съдържат до 0,2% холестерол.
Минерали. Минералите на мускулната тъкан съставляват приблизително 1 - 1,5% от мускулното тегло, това са главно соли на калий, натрий, калций, магнезий. Минерални йони като K +, Na +, Mg 2+, Ca 2+, Cl -, HP04
играят важна роля в биохимичните процеси при мускулна контракция (включват се в състава на "спортни" добавки и минерална вода).
Биохимия на мускулните протеини.
Основният контрактилен мускулен протеин -миозин се отнася до фибриларни протеини (молекулно тегло е около 470 000). Важна характеристика на миозина е способността да образува комплекси с АТФ молекули.и ADP (което ви позволява да "отнемете" енергия от ATP), и с протеин - актин (което ви позволява да задържите свиването).
Молекулата на миозина има отрицателен заряд и специфично взаимодейства с Ca ++ и Mg ++ йони. Миозинът в присъствието на Ca ++ йони ускорява хидролизата на АТФ и по този начин проявява ензимнааденозин трифосфатна активност:
миозин-ATP +H2O→ миозин + ADP + H3PO4+ работа (енергия 40 kJ/mol)
Миозиновият протеин се образува от две еднакви, дълги полипептидни α-вериги, усукани като двойна спирала, фиг.7. Под действието на протеолитичните ензими молекулата на миозина се разпада на две части. Една от неговите части е в състояние да се свърже чрез сраствания с актин, образувайки актомиозин. Тази част е отговорна за активността на аденозинтрифосфатазата, която зависи от pH на средата, оптималното е pH 6,0 - 9,5, както и концентрацията на KCl. Актомиозиновият комплекс се разпада в присъствието на АТФ, но е стабилен в отсъствието на свободен АТФ. Втората част на миозиновата молекула също се състои от две усукани спирали, които поради електростатичния заряд свързват миозиновите молекули в протофибрили.
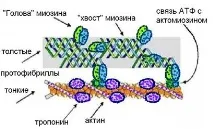
Ориз. 7. Строеж на актомиозин.
Вторият най-важен контрактилен протеин еактин (фиг. 7). Може да съществува в три форми: мономерна (глобуларна), димерна (глобуларна) и полимерна (фибриларна). Мономерният глобуларен актин, когато неговите полипептидни вериги са плътно опаковани в компактна сферична структура, се свързва с АТФ. Разделяне на ATP, актинови мономери - A, образуват димери, включително ADP: A - ADP - A. Полимерният фибриларен актин е двойна спирала, състояща се от димери, фиг. 7.
Глобуларният актин се трансформира във фибриларен актин в присъствието на K +, Mg ++ йони, а фибриларният актин преобладава в живите мускули.
Миофибрилите съдържат значително количество протеинтропомиозин, който се състои от две α-спирални полипептидни вериги. В почиващите мускули той образува комплекс с актин и блокира неговите активни центрове, тъй като актинът е в състояние да се свърже с Ca ++ йони и те премахват тази блокада.
На молекулярно ниво дебелите и тънките протофибрили на саркомера си взаимодействат електростатично, тъй като имат специални зони - израстъци и издатини, където се образува зарядът. В областта на А-диска дебелите протофибрили са изградени от сноп от надлъжно ориентирани миозинови молекули, тънките протофибрили са разположени радиално около дебелите, образувайки структура, подобна на многожилен кабел. В централната М-лента на дебели протофибрили молекулите на миозина са свързани с техните "опашки", а техните изпъкнали "глави" - израстъци са насочени в различни посоки и са разположени по редовни спирални линии. Всъщност, срещу тях в спиралите на фибриларния актин, на известно разстояние една от друга, също изпъкват мономерни актинови глобули. Всяка издатина имаактивен център, поради което е възможно образуването на сраствания с миозин. Z-мембраните на саркомерите (като редуващи се пиедестали) закрепват тънки протофибрили заедно.