Tutor_po_Khimii - Страница 2
Неутронът е неутрална частица, зарядът на неутрона е 0.
Неутронният символ е 0 n .
Ядрата на атомите имат положителен заряд, тъй като се състоят от протони с положителен заряд и неутрални.
Около ядрото се движат електрони, които имат отрицателен заряд. Заряд на електрона в условни единици
вени -1. Електронният символ е e#.
• Протоните, неутроните и електроните се наричат елементарни
Всеки атом съдържа равен брой протони и електрони, така че сумата от положителните заряди в атома е
сбор от отрицателни заряди. Следователно атомите са
са електрически неутрални частици.
Ядрата на различните атоми съдържат различен брой протони.
• Основната характеристика на всеки атом е ядреният заряд, който се обозначава с буквата Z и е равен на броя на протоните.
• Типът атоми с еднакъв ядрен заряд се нарича химичен елемент.
Всеки елемент има свое име и свой символ (знак).
В момента са известни повече от 100 химични елемента. Сред тях има елементи, които се срещат в природата (около 90), и елементи, които са получени по изкуствен път (≈ 20).
Всеки елемент има свое име и свой символ (химичен знак). Символите на елементите се състоят от една или две букви от латинското наименование на елементите и са международни. Имената на елементите на всеки език са различни.
Например елементът с българско име водород носи символа H (чете се „пепел“), което е първата буква от латинското име на този елемент – Hydrogenium. Елементът с българско име хлор носи символа Cl (чете се "хлор"), който се образува от първата и третата буква на латинското име - Chlorum.
В табл. 1 съдържа български и латински именанай-важните химични елементи, техните символи и произношението на символите в химичните формули.
Имена и символи на най-важните химични елементи
Ще се запознаете с имената и символите на други химични елементи в хода на по-нататъшното изучаване на курса по химия.
Помислете за примери за произношението на символи в химически формули:
Ca 3 (PO 4) 2 - "калций-три-пе-о-четири-два пъти" NaCl - "натрий-хлор"
Al 2 (SO 4) 3 - "алуминий-две-ес-о-четири-три пъти"
AgNO 3 - "аргентум-ен-о-три"
[Fe (OH) 2 ] 2 S - „ferrum-o-ash-twice-twice-es”
Всички химични елементи са разделени на метали и неметали (таблица 2). Причината за това разделение са разликите в структурата на атомите. Те ще бъдат взети предвид при изучаване на съответната тема. Но вече е необходимо да запомните кои елементи са метали и кои са неметали.
Разделянето на химичните елементи на метали и неметали
Разпространението на различни химични елементи
не е същото в природата.
В земната кора най-често срещаните елементи са: кислород O (≈ 49%), силиций Si (≈ 27%), алуминий Al (≈ 8%), желязо Fe (≈ 5%), калций Ca, натрий Na, калий K, магнезий Mg, титан Ti, водород H. Тези десет елемента
Тов съставляват повече от 99% от масата на земната кора. Най-важните елементи на морската вода са O, H, Na, Cl, а на живата материя - O, C и H.
Въпроси за контрол
1. Как се наричат частиците, които образуват всички вещества?
2. Какво се намира в центъра на атома?
3. От какво се състои ядрото на атома?
4. Какво е общоприетото име за протони и неутрони?
5. Какъв е зарядът на протона в условни единици?
6. Какъв заряд имат ядрата на атомите? Защо?
7. Как се наричат частиците, които се движатядрото на атома?
8. Какъв е зарядът на електрона в произволни единици?
9. Какво е общоприетото име за протони, неутрони и електрони? 10. Защо атомите са електрически неутрални частици?
11. Каква е основната характеристика на всеки атом?
12. Какъв е зарядът на ядрото на атома?
13. Какво се нарича химичен елемент?
14. Колко химични елемента са известни в момента?
15. Колко химични елемента се срещат в природата?
16. Колко химични елемента са получени по изкуствен път?
17. На кои две групи се делят всички химични елементи?
18. Кои химични елементи са най-разпространени: а) в земната кора; б) в морска вода?
19. Кои химични елементи са най-важните елементи на живата материя?
Задачи за самостоятелна работа
1. Попълнете празните клетки в следната таблица (всеки ред в таблицата отговаря на един атом):
Какъв е общият брой на елементарните частици във всеки от атомите
2. Напишете как се произнасят следните формули: HCl, H 2 SO 4 , NaNO 3 , C 6 H 12 O 6 , Mg (NO 3 ) 2 , Fe 2 (SO 4 ) 3 .
3. Напишете формули, които имат следното произношение: „калций-флуор-две“, „це-дванадесет-пепел-двадесет-две-о-единадесет“, „купрум-три-пе-о-четири-два пъти“, „пепел-хлор-о-четири“.
4. Напишете българските наименования и символи за металите, които са най-разпространени в земната кора.
§ 1.3. Размери на атома. Абсолютни и относителни атомни маси
Атомите на различните елементи имат различни размери и различни маси.
Тъй като атомите имат сферична форма, техните размери се характеризират с диаметър или радиус.
Най-малкият атом е водороден атом, неговият диаметър е приблизително 1 10 -8 cm, или 1 10 -10м. Диаметърът на хлорния атом е ≈ 1,8 10 -8 cm и т.н.
За изразяване на такива малки количества често се използват единици за дължина, които се наричат ангстрьоми (Å) и
В тези единици диаметърът на водороден атом е приблизително lÅ или 0,1 nm.
Масите на атомите също са много малки количества.
Масите на атомите, които се изразяват в условни единици за маса (kg или g), се наричат абсолютни атомни маси.
mi и се означават със символа m a .
Водородният атом има най-малката маса: m a (H) \u003d 1,67 10 -27 kg \u003d 1,67 10 -24 g
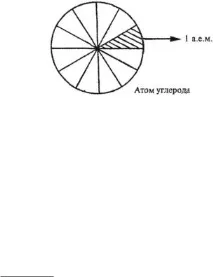
Абсолютните маси на въглеродните и кислородните атоми имат следните стойности:
m a (C) \u003d 19,93 10 -27 kg; m a (O) \u003d 26,67 10 -27 kg Много е неудобно да се използват такива малки стойности. от-
Следователно в химията вместо абсолютни атомни маси обикновено се използват относителни атомни маси.
1/12 от абсолютната маса на въглеродния атом С се приема за единица атомна маса. Ако си представим въглероден атом
под формата на топка и мислено я разделете на 12 равни части, тогава масата на една част е атомната единица маса
Ориз. 1. Към дефиницията на единицата за атомна маса
• Единицата за атомна маса (a.m.u.) е 1/12 от абсолютната маса на въглероден атом.
Като знаем абсолютната маса на въглеродния атом, можем да изразим a. e.m. в kg или в g:
• Относителната атомна маса на даден елемент е число, което показва колко пъти абсолютната маса на атом на даден елемент е по-голяма от 1/12 от абсолютната маса на въглероден атом, т.е. единица атомна маса *.
Ще бъде дадено по-точно определение на относителната атомна маса
след изучаване на теорията за структурата на атома.
Относителната атомна маса се обозначава със символа A r (индексът "r" е първата буква на англ.думите "роднина" - роднина).
Относителната атомна маса на елемента X е:
Нека изчислим например относителните атомни маси на водорода и кислорода:
m a (H) 1,67 10 -27 кг
A r (X) = —————— = ———————— ≈ 1,1 a. е. м. 1,66 10 -27 кг
m a (O) 26,67 10 -27 кг
A r (O) = ————— = ———————— ≈ 16. 1 a. е. м. 1,66 10 -27 кг
Така масата на водородния атом е приблизително равна на масата на 1/12 от въглеродния атом, а масата на кислородния атом е приблизително 16 пъти масата на 1/12 от въглеродния атом.
Обърнете внимание, че относителните атомни маси
елементи, като всички относителни стойности, са
Обикновено се използват приблизителни стойности на относителните атомни маси.
В табл. 3 дава приблизителните стойности на относителните атомни маси на някои елементи.
Относителни атомни маси на някои химични елементи
Въпроси за контрол
1. Какво характеризира размера на атомите?
2. Какви единици за дължина се използват за изразяване на диаметрите или радиусите на атомите?
3. Какво се нарича абсолютна атомна маса?
4. Какви атомни маси обикновено се използват в химията?
5. Какво се приема за единица атомни маси?
6. Каква е относителната атомна маса на химичен елемент? Какъв символ представлява?
Задачи за самостоятелна работа
1. Диаметърът на хлорния атом е 1,8 10 -8 см. Изразете го в ангстрьоми
2. Колко ангстрьома и нанометра има в: а) 1 m? б) 1 см?
3. Пресметнете колко атомни единици за маса има в: а) 1 kg; б) 1 година
4. Използвайки относителните атомни маси на елементите (виж таблица 3), изчислете колко пъти масата на един меден атом е по-голяма от масата на: а) серен атом; б) кислороден атом; V)водороден атом.
§ 1.4. Молекули. Химични формули. молекулни тегла. Елементен състав на веществата
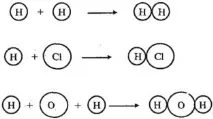
Атомите могат да се свързват един с друг. В резултат на тази връзка обикновено се образуват по-сложни частици - молекули. Например:
Тези примери показват, че атомите на един и същи елемент и атомите на различни елементи могат да се комбинират помежду си. Броят на атомите, които са свързани един с друг, може
Съставът на всяка молекула може да бъде изразен с химична формула.
И така, молекулата на водорода има формула H 2 . Числото "2" в тази формула показва броя на водородните атоми във водородната молекула.
Числа в химически формули, които показват
колко атома на даден елемент са част от една молекула се наричат индекси.
Молекулата на хлороводорода има формулата HCl, тъй като се състои от един водороден атом и един хлорен атом. Молекулата на водата има формула H2O. Тази формула показва, че водната молекула се състои от два водородни атома и един
един кислороден атом.
Молекулата на сярната киселина се състои от два водородни атома Н, един серен атом S и четири кислородни атома О. Следователно формулата на молекулата на сярната киселина е H2SO4.
Има молекули, които включват няколко еднакви групи атоми. Във формулите на такива молекули тези групи от атоми са затворени в скоби, а индексът извън скобите показва броя на тези групи в молекулата. Например, формулата Cu(NO 3 ) 2 показва, че тази молекула се състои от един меден атом и две групи от NO 3 атоми, т.е. два азотни атома
и шест кислородни атома.
По този начин химичните формули показват качествения и количествения състав на молекулата (от атомите на всяка
от кои елементи се състои една молекула и в колко от тези атоми има
Според закона за постоянствотокомпозиция (Ж. Пруст, Франция, 1808 г.):
• Всяко чисто вещество има постоянен качествен и количествен състав, който не зависи от начина на получаване на веществото.
Тъй като веществото се състои от еднакви молекули, съставът на молекулата определя състава на цялото вещество. Разлики
в химичните свойства на веществата поради разликите
в състава и структурата на молекулите, изграждащи тези вещества. Следователно можем да заключим:
• Молекулата е най-малката частица от веществото, която запазва своите химични свойства.
Масата на всяка молекула е равна на сбора от масите на нейните съставни части
атоми. Ако се използват относителни атомни маси за изчисляване на масата на една молекула, тогава се получава относителната молекулна маса, която се обозначава със символа M g.
Например, относителното молекулно тегло на водата H 2 O
M r (H 2 O) \u003d A r (H) + Ar (H) + A r (O) \u003d
\u003d 2A r (H) + A r (O) \u003d 2 1 + 16 \u003d 18; относително молекулно тегло на железен (III) сулфат
Fe 2 (SO 4) 3 е равно на:
M r [Fe 2 (SO 4) 3] \u003d 2A r (Fe) + 3A r (S) + 12A r (O) \u003d
= 2 56 + 3 32 + 12 16 = 400
• Относителното молекулно тегло на веществото Mg е число, което показва колко пъти е абсолютното
масата на молекула на дадено вещество е по-голяма от 1/12 от абсолютната маса на въглероден атом C.
Например, относителното молекулно тегло на водата е M r (H 2 O) = 18. Това означава, че масата на една водна молекула е 18 пъти по-голяма от 1/12 от масата на въглероден атом.
Относителните молекулни маси, както и относителните атомни маси, са безразмерни величини.
Използвайки формулата на веществото, можете да изчислите масовата част на всеки химичен елемент, който е част от веществото.
• Масова част (ω) на химичен елемент вдадено вещество е равно на съотношението на относителната атомна маса на даден елемент, умножена по броя на неговите атоми в молекула, към относителната молекулна маса на веществото: