Защо литиевите батерии експлодират?
Коренът на проблема с литиевите батерии
Факт е, че в процеса на зареждане на литиева батерия в мобилно устройство, използвайки микроконтролера, вграден в батерията, се прилага доста сложен алгоритъм за изпълнение на този процес, така че температурата на батерията да не надхвърля приемливия температурен диапазон. За тази цел контролерът следи много параметри на батерията по време на нейното зареждане.
В допълнение към самия процес на зареждане, съхранението на батерията също изисква спазване на определени правила, особено по отношение на температурата: не можете нито да прегреете, нито да охладите батерията.

Основният проблем, водещ до експлозия на батериите, епрекомерното нагряване на електролита поради превишаване на допустимата температура или поради късо съединение в клетката на акумулатора. Верижна реакция лесно се инициира в прегрята клетка, тъй като алкалният метал литий е много запалим, което кара батерията да се подува и в най-лошия случай да експлодира.
И дори въпреки наличието на „внимателен“ контролер, може да възникне случаен фабричен дефект (недостатъчна дебелина на изолатора между клетките) и да доведе до тъжни последици.
Разбира се, удари, повреди, пробиви, прегряване на слънце са опасни. Дори ако батерията бъде изпусната и леко ударена, изолаторът вътре може да се счупи и това може да доведе до внезапни проблеми по-късно, дори без очевидно прегряване.
Причина за опасност от експлозия на литиеви батерии
Анодът и катодът на литиево-йонна батерия са разделени от порест полимерен сепаратор. Катодът има активен материал върху него, който често се използва като оксиди на преходни метали, в коитовградени литиеви йони. Анодът обикновено е графитен. Като електролит се използва органичен разтвор на литиеви соли.
При първото зареждане във фабриката литият се вгражда в анода и върху електродите се образува слой от разложен електролит, който сега служи като защита срещу ненужни реакции, като същевременно остава йоннопроводим.
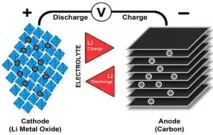
Както беше отбелязано по-горе, вътрешното късо съединение е една от основните причини за спонтанно запалване на батерията. Причината за самото късо съединение може да бъде физическа повреда или фабрични дефекти, като неравномерно изрязване на електродите или попадане на метални частици между катода и анода, които нарушават целостта на разделителния слой.
Друга причина за късото съединение е нарастването на литиеви метални вериги през сепаратора (ако литиевите йони не са имали време да се интегрират напълно в анодния кристал във фабриката поради прекалено бързо зареждане или от хипотермия, или ако капацитетът на активния материал на катода е по-голям от капацитета на анода, което води до отлагания върху анода, които след това бавно, но неумолимо нарастват).
Така че, ако е възникнало късо съединение, тогава температурата на батерията започва да се повишава и когато достигне 70-90 ° C, започва разлагането на защитния йон-проводим слой на анода. Литият на анода реагира с електролита и се отделят горими въглеводороди като етилен, метан, етан и др.. Но все още е рано да се запали, защото няма достатъчно кислород.
Междувременно протича екзотермична реакция и температурата се повишава, налягането в корпуса на батерията се увеличава. При 180-200°C реакцията на диспропорциониране започва от катода, където се отделя кислород. Получава се запалване, температурата се повишава рязко и електролитът термично се разлага, температурата вече е 200-300°C.
Накрая идва ред на графита и скогато температурата достигне 660°C, алуминият на пантографа започва да се топи. Максималната температура в целия този процес обикновено не надвишава 900°C, тъй като всичко бързо приключва с пълното разграждане на вътрешните компоненти на батерията.

Вече има напредък в намирането на решение на проблема
Междувременно за безопасността на литиевите батерии се борят физици от Станфорд, които през лятото на 2015 г. разработиха специален защитен механизъм, който е вграден в батерията още на етапа на производство.
Всъщност говорим за нов тип литиеви батерии, които автоматично се изключват, когато вътрешностите им достигнат потенциално опасна температура (което предотвратява процеса, водещ до последващо запалване), и след известно време, след като изстинат, автоматично се включват отново.
Авторите на разработката твърдят, че това е първата литиева батерия, която може многократно да се изключва и възстановява, без да губи своите свойства и производителност.
Разработката се извършва в продължение на няколко години от екип от няколко души (включително Zhenan Bao), в резултат на което се получава батерия, която е лишена от два основни недостатъка - рязко намаляване на капацитета на батерията след няколко цикъла на презареждане и, което е по-важно, склонност към запалване и експлозия поради прегряване (верижната реакция автоматично спира).
Решението дойде на учени от съвсем различна област на физиката. Те направиха термометри, използвайки никелови наночастици, вградени в тънък лист от графен и пластмаса. Това бяха необичайни термометри. В покой никеловите частици бяха в контакт помежду си, тоест се получи добър проводник на ток. Но когато листът се нагрее, пластмасата започна леко да се разширява, което доведе до отслабване на контакта между проводимия никелчастици и съпротивлението на целия проводник се увеличава.
Именно това свойство са използвали изследователи от Станфорд за незабавна автоматична защита на литиевите батерии и за пълно автоматично възстановяване на контакта след охлаждане. Те залепиха лист от тази пластмаса към един от електродите на батерията, така че тя да загуби проводимост при повишаване на температурата. И когато температурата достигне 70°C

Но въпреки намереното решение, производителите на мобилни устройства все още не смеят да променят драстично технологията, която е разработвана през годините за производство на техните батерии. Следователно потребителите на джаджи ще трябва да се примирят с потенциалната опасност от литиевите батерии за известно време и да се опитат да не изпускат или прегряват мобилните си устройства и още повече батериите. Може би в близко бъдеще проблемът ще бъде напълно решен.