9. Обща характеристика и химични свойства на фосфора, производството му в промишлеността.
Фосфорни оксиди: получаване, молекулна структура и свойства.
Фосфор и фосфорни киселини: получаване, молекулна структура, киселинно-алкални и редокс свойства. Фосфити и хипофосфити.
Фосфорни киселини (+5) и качествени реакции към тях. Получаване на фосфорна киселина в промишлеността.
В естествени условия фосфорът е представен от минералите фосфорит Сa3(PO4)2 и апатит 3Ca3(PO4)2*CaX2 (X=F,Cl,OH).Човешкото тяло съдържа средно около килограм и половина фосфор. Описани са 11 модификации на фосфора, като всяка модификация е полиморфна. Най-голям интерес представляват белият, червеният и черният фосфор. Белият фосфор е меко, реактивно, много токсично вещество, съхранявано под слой вода, тъй като се запалва спонтанно във въздуха.Белият фосфор е представен от молекули P4, които имат формата на тетраедър и се разлагат при температури над 800 до молекули P2.Тези молекули са по-малко издръжливи от молекулите N2.При продължително нагряване над 250 белият фосфор се превръща в червен фосфорът, който е доста стабилен на въздух, не е отровен и се запалва само при нагряване над 400. Черният фосфор, който е най-стабилната модификация, се получава от бял фосфор при високо налягане. Черният фосфор е мазен на пипане, подобен на графит, полупроводникът не е отровен.
От всички алотропни модификации на фосфора, белият фосфор се приема като стандартно състояние, въпреки че не е най-термодинамично стабилната модификация.
Бял фосфор се получава чрез калциниране на фосфорна руда с кокс и кварцов пясък в електрическа пещ: Ca3(PO4)2+5C+3Sio2=(t)=2P+3CaSiO3+5CO.
Възможностите на валентността на фосфорния атом според метода BC 3 и 5, степента на окисление в съединенията варира от -3 до +5, фосфорният атом, за разлика от азотния атом, имавъзможността за донорно-акцепторен механизъм поради свободни d-орбитали.
Окисляването на фосфора води до два оксида P4O6 и P4O10, първият се образува с липса на кислород (излишък на фосфор), а вторият с излишък на кислород
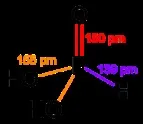
Молекулите на тези оксиди запазват тетраедричната структура на молекулата на белия фосфор. В оксида P4O6 всеки ръб на тетраедъра P4 е „вграден“ с кислороден атом, а в оксида P4O10 кислороден атом също е прикрепен към всеки фосфорен атом, разположен във върховете на тетраедъра.
Фосфорът реагира относително лесно със сяра, халогени и други неметали:
P4+10S=P4S10 (и други връзки)
Когато металните прахове се синтероват с фосфор, се образуват метални фосфиди
Фосфорът е безразличен към водни разтвори на минерални киселини. Реагира бавно с окислителни киселини:
В топъл алкален разтвор P4 диспропорционира
Може да се получи фосфорна киселина
Ba(H2PO2)2+H2SO4=BaSO4+2H3PO24
H3PO2 - единична основа, достатъчно силна
Солите на хипофосфорната киселина се наричат хипофосфити, те са добри редуциращи агенти, лесно се окисляват до фосфорни съединения 3 и 5 и се използват за химическа метализация на диелектрици:
Анхидридната киселина H3PO2 няма.
Фосфорната киселина, H2(PHO3), е двуосновна във водни разтвори и формално триосновна киселина със средна сила.
7P4O6+30H2O(hort)=2PH3+2P4+18H3PO4
Фосфитите са добри редуциращи агенти; при OVR те се окисляват до фосфорни съединения 5
Разтворите на мета- и пирофосфорни киселини са доста трудни за разграничаване, досега за определяне на тези киселини се използва буквално старата рецепта - мета-гънки яйчен белтък, пиро-не.
Качествена реакция към йона PO4 3− е образуването на ярко жълтоутайка от амониев молибденов фосфат: