Атипичен хемолитично-уремичен синдром при деца, издателство "Практика".
Атипичният HUS (aHUS) е заболяване, причинено от дисрегулация на алтернативния път на активиране на комплемента. Критериите за диагностициране на aHUS са: 1) липса на съпътстващо заболяване; 2) липса на критерии за HUS, свързан с Shiga токсина; 3) липса на критерии за тромботична тромбоцитопенична пурпура. Досега плазмената терапия е терапия от първа линия. Нова терапевтична възможност в света днес се превърна в използването на моноклонални антитела - инхибитори на системата на комплемента (блокер на C5 компонента на комплемента). Единственият представител на тази група е лекарството екулизумаб (Soliris).
Атипичен хемолитичен уремичен синдром при деца
Атипичният HUS (aHUS) е заболяване, причинено от дисрегулация на алтернативния път на активиране на комплемента. Критериите за диагностициране на aHUS са: 1) липса на свързани заболявания, 2) липса на критерии за HUS, свързан с Shiga токсин, 3) липса на критерии за тромботична тромбоцитопенична пурпура. Към днешна дата терапията от първа линия е плазмената терапия. Нова терапевтична възможност в света днес е използването на моноклонални антитела - инхибитори на системата на комплемента (блокер на компонента на комплемента С5). Единственият представител на тази група е лекарството екулизумаб (Soliris).
aHUS обозначава първично заболяване, дължащо се на нарушение в регулирането на алтернативния път на комплемента. Диагнозата на aHUS се основава на 1) Няма свързано заболяване 2) Няма критерии за Shigatoxin-HUS 3) Няма критерии за тромботична тромбоцитопенична пурпура (активност на серум ADAMTS 13> 10%). Плазмотерапията доскоро беше лечение на първа линия. Нов подход в терапията на аХУС е приложението на екулизумаб - инхибитор на С5 на компонента на комплемента.
Хемолитичен уремичен синдром(HUS) е една от честите причини за остра бъбречна недостатъчност при деца. Характеризира се с триада от признаци: хемолитична анемия с наличие на фрагментирани еритроцити (шизоцити), тромбоцитопения и остра бъбречна недостатъчност [1-3]. Има много разновидности на HUS, които имат както общи патогенетични механизми на развитие, така и хистологични прояви, наречени тромботична микроангиопатия [4]. В резултат на увреждане на ендотелните клетки възниква механично увреждане на еритроцитите, активиране на тромбоцитната агрегация с образуване на тромби в микроваскулатурата, особено в бъбреците [5].
Повечето (90-95%) деца имат така наречения типичен или постдиарейен HUS, (D+HUS), който е вторичен на инфекция с Escherichia coli, произвеждаща шигатоксин (Stx) (Stx-продуцираща E coli, Stx-HUS). Друга форма на HUS, наречена атипична (aHUS, Non-Stx-HUS), е много по-рядко срещана (5-10% от всички случаи) и е резултат от аномалия (често генетична) на протеини, които регулират процеса на активиране на комплемента.
Въпреки разнообразието от класификации на HUS, напоследък широко се използва вариант, който взема предвид отношението към Shiga токсина (Таблица 1) [1].
Класификация на хемолитичен уремичен синдром
-Shigella dysenteriae, тип 1
- Медикаменти (антинеопластични, антитромбоцитни, имуносупресивни лекарства)
- По време на бременност
- Системни заболявания: системен лупус еритематозус, склеродермия, антифосфолипиден синдром.
Атипичният вариант на HUS представлява 5-10% от всички случаи на HUS при деца, е
генетично прогресивно заболяване с изключително висок риск от внезапна смърт и необратимо инвалидизиращо увреждане на жизненитеоргани, включително бъбреците, черния дроб, сърцето и мозъка. AHUS се основава на тромботична микроангиопатия (ТМА), свързана с неконтролирано активиране на системата на комплемента [6, 7, 8, 9]. Основният целеви орган на микроангиопатичната тромбоза са бъбреците, но в някои случаи е възможна генерализация на ТМА, водеща до развитие на полиорганна исхемия с картина на полиорганна недостатъчност [9, 10, 5]. Отделни редки случаи при кърмачета са резултат от наследствена аномалия във вътреклетъчния метаболизъм на коболамин (витамин В12) (метилмалонова ацидемия) [11]. Трябва да се отбележи, че aHUS е хронично заболяване, което изисква наблюдение и лечение през целия живот.
Честотата и разпространението на aHUS не са добре разбрани. Според различни източници, в страни с достатъчно ниво на диагностика, разпространението на заболяването е от 1 до 3 пациенти с aHUS на 1 милион население. Заболяването често се проявява при деца под 18-годишна възраст, но в около 40% от случаите се диагностицира в зряла възраст. В България до момента са диагностицирани много по-малко пациенти от очакваното според наличните чужди епидемиологични данни. Това се дължи на ограничените възможности за специални изследвания (ADAMTS13, генни мутации) при диагностицирането на aHUS. Междувременно няма съмнение, че постоянното нарастване на броя на пациентите с тази не нова, но практически неизвестна форма на спешна патология в близко бъдеще може да се превърне в сериозна задача, която самият живот ще постави пред лекари от различни специалности.
Патогенеза. Още през 1970-1980 г. беше наблюдавано, че редица пациенти с aHUS имат ниски плазмени нива на C3 [12]. През последните 10 години беше постигнат впечатляващ напредък, който демонстрира, че 4регулаторните протеини на алтернативния път на активиране на комплемента фактор Н (CFH), мембранен кофакторен протеин (MCP или CD46), фактор I (CFI) и тромбомодулин (THBD), както и 2 протеина С3-конвертаза, С3 и фактор В (CFB) играят роля в патогенезата на aHUS [3, 6, 13, 14].
Системата на комплемента е основният механизъм на антибактериалната защита. Има три начина за активиране на системата на комплемента: класически, лектин и алтернативен [15] (фиг. 1).
Фигура 1 Пътища за активиране на комплемента
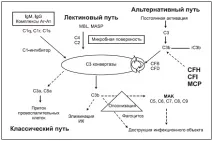
C. Loirat, V. Frémeaux-Bacchi. Нефрология. - 2012. - Т. 16, № 2.
И трите от тези пътища се събират в точката на разцепване С3 на фракцията на комплемента. Докато активирането на класическия и лектиновия път започва след свързване съответно с имунни комплекси или микроорганизми, алтернативният път се активира непрекъснато, за да се образува C3b, който се свързва безразборно с патогени и клетки гостоприемници. На чужда повърхност, като например бактериална, C3b свързва CFB, който след това се разцепва от фактор D, за да образува C3 конвертаза C3bBb. C3bBb експоненциално разцепва C3 (усилваща верига) и образува C5 конвертаза (C3bBb (C3b)n). Компонентът C5b, получен в резултат на разцепването на C5, участва в образуването на комплекса за атака на мембраната (MAC) C5b9, който причинява опсонизация, фагоцитоза и бактериален лизис (фиг. 1). Този отговор обикновено е строго контролиран на повърхността на клетките-гостоприемници, които са защитени от локално усилване на C3b отлагания чрез редица протеини за контрол на комплемента: CFH (плазмен гликопротеин, кофактор за CFI), CFI (плазмена серинова протеаза, която разцепва и инактивира C3b, за да образува iC3b в присъствието на кофактори, включително MCP (нециркулиращ гликопротеин, включен вмембраните на всички клетки с изключение на еритроцитите) и евентуално THBD (тромбомодулин). THBD е ендотелен гликопротеин с антикоагулантни, противовъзпалителни и цитопротективни свойства, който също е регулаторен протеин на системата на комплемента (16). В присъствието на CFH, CFH и CFB се конкурират за свързване на C3b, което ограничава образуването на C3 конвертаза. Когато CFH е свързан с C3b, фиксиран върху клетъчната повърхност, CFB вече не е в състояние да участва в образуването на C3 конвертаза.
CFH (фактор H) е най-важният протеин в регулацията на алтернативния път на комплемента (17, 18). Състои се от 20 къси консенсусни повторения (SCRs) (фиг. 2) и съдържа най-малко два C3b-свързващи региона.
Фигура 2. Регулиране на активиране на алтернативен път
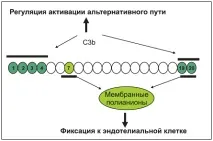
(C. Loirat, V. Frémeaux-Bacchi. Нефрология. - 2012. - V. 16, № 2).
Първото C3b-свързващо място, което регулира течната фаза на усилване на алтернативния път, се намира в N-терминалния край на SCR1-4. Второто място на свързване на C3b е разположено в SCR19-20 C крайния домейн. CFH също така съдържа две полианионни свързващи места при SCR7 и SCR19-20. Ендотелните клетки са богати на полианионни молекули, по-специално гликозаминогликани. Защитата на клетките-гостоприемници зависи от инактивирането на повърхностно-свързания C3b вследствие на свързването на CFH с повърхностно-свързания C3b. Всички скорошни научни изследвания ще демонстрират ясно ролята на SCR19-20 в защитата на ендотелните клетки [16, 19, 17]. Четири протеина - CFH, CFI, MCP и THBD - взаимодействат локално, за да разцепят C3b до неактивна молекула (iC3b). Мутациите в тези протеини водят до загуба на защита на ендотелните клетки.
aHUS се свързва с CFH мутации в 20-25%пациенти, MCP при ≈15% и CFI при ≈10%. Мутациите на фактор B (CFB) са изключително редки (1%) [20], докато мутациите на комплемента C3 се срещат при 10% от пациентите [21]. Приблизително 10% от децата имат свързани мутации. В допълнение, 10% от децата са придобили функционален дефицит на CFH поради наличието на анти-CFH антитела. Само 30% от aHUS днес не намират правилно обяснение [3].
Предполага се, че мутациите в гените CFH, MCP, CFI и THBD, открити при пациенти с aHUS, водят до образуване на дефект в защитата на ендотелните клетки от активирането на системата на комплемента [8, 18, 19, 22, 23, 24, 25]. Като цяло, всички идентифицирани генетични дефекти водят до повишено производство на C3 конвертаза, и следователно C5 конвертаза, и разцепване на C5. В резултат на това освобождаването на C5a и MAC на повърхността на ендотелните клетки се увеличава, причинявайки им допълнително увреждане с експониране на субендотелния матрикс и образуване на кръвни съсиреци. Това води до консумация на тромбоцити и увреждане на червените кръвни клетки. Освен това е доказана значителна роля на CFH в регулирането на структурата и функцията на тромбоцитите. При наличие на С-терминални мутации, способността на CFH да се свързва с тромбоцитите е намалена, което води до активиране на комплемента върху повърхността на тромбоцитите. Това от своя страна предизвиква активиране на тромбоцитите, тяхната агрегация, освобождаване на микрочастици, експресиращи тъканен фактор, и насърчава образуването на тромби в микроваскулатурата [23, 24].
Клинична изява на аХУС.
Много ранното начало (дори в неонаталния период) е характерно за aHUS, свързан с CFH и CFI мутации (средна възраст съответно 6 месеца и 2 месеца). Обратно, при MCP мутация, началото на заболяването винаги е по-старо от 1 година. Етиологично неопределени варианти на aHUSможе да започне на всяка възраст. Анти-CFH антителата са по-чести към юношеството.
Провокиращи фактори са някои инфекции (горни дихателни пътища, треска, гастроентерит), отключват първия епизод на аХУС и рецидиви независимо от генетичния вариант при 2/3 от пациентите. Диарията провокира aHUS при 1/3 от пациентите, което понякога затруднява разграничаването от D+ HUS.
Приблизително 25% от пациентите с aHUS са фамилни (братя и сестри, родители, баби и дядовци имат заболяването). Неусложнената фамилна анамнеза не изключва възможността за генетично предаване на заболяването. Само половината от носителите на мутацията в семейството през живота си имат проява на заболяването.
Началото на заболяването обикновено е внезапно.Симптомите при малки деца са бледност, общо неразположение, лош апетит, повръщане, сънливост и понякога оток.Извънбъбречните прояви под формата на увреждане на ЦНС се проявяват с конвулсии, ступор, кома и се откриват при по-малко от 20% от пациентите. В патогенезата на енцефалопатията няколко фактора играят важна роля едновременно: церебрален оток, хипоксия, кръвоизливи в мозъчното вещество. Масовата интраваскуларна консумация на тромбоцити може да провокира развитието на коагулопатия на потреблението: хипер- или хипокоагулация, хипопротромбинемия, хипофибриногенемия, повишени нива на продукти на разграждане на фибрин, D-димер, забавена фибринолиза, нарушена агрегация на тромбоцитите.
In most patients, the first laboratory examination reveals the complete diagnostic triad of HUS: hemoglobin 40-90 g/l thrombocytopenia (9/l) with no or little risk of hemorrhagic complications and renal dysfunction (urea > 8 mmol/l, creatinine > 110 µmol/l), with or without anuria, oliguria, proteinuria with preservedдиуреза. Левкоцитоза, умерено изразена ретикулоцитоза. За потвърждаване на неимунния характер на анемията се провежда тестът на Coombs - отрицателен за HUS. Наличието на шистоцити, както и неоткриваем хаптоглобин, в комбинация с високо ниво на LDH, потвърждават микроангиопатичната интраваскуларна генеза на хемолизата. В случай на забавена диагноза могат да възникнат животозастрашаващи усложнения: хиперкалиемия (≥6 mmol/l), ацидоза (серумен бикарбонат 1 година + нормално ниво на C3