Билет номер 22 Експериментите на Ръдърфорд върху разсейването на α-частици
1. Опитите на Ръдърфорд. 2. Ядрен модел на атома.
Думата "атом" на гръцки означава "неделим". Дълго време, до началото на 20 век, атомът означаваше най-малките неделими частици материя. До началото наXXв. науката е натрупала много факти, които говорят за сложната структура на атомите.
Голям напредък в изучаването на структурата на атомите беше постигнат в експериментите на английския учен Ърнест Ръдърфорд върху разсейването на a-частици при преминаване през тънки слоеве материя. В тези експерименти тесен лъч отα-частици, излъчвани от радиоактивно вещество, беше насочен върху тънко златно фолио. Зад фолиото беше поставен екран, способен да свети под въздействието на бързи частици. Беше установено, че по-голямата част отα-частиците се отклоняват от праволинейно разпространение след преминаване през фолиото, т.е. те се разпръскват, а някоиα-частици обикновено се изхвърлят обратно. Ръдърфорд обяснява разсейването наα-частиците с факта, чеположителният зарядне е разпределен равномерно в топка с радиус 10 -10 m, както се предполагаше по-рано, а е концентриран в централната част на атома - атомното ядро. При преминаване близо до ядротоα-частицата с положителен заряд се отблъсква от него, а при удара в ядрото се изхвърля в обратна посока. Така се държат частиците с еднакъв заряд, следователно има централна положително заредена част от атома, в която е концентрирана значителна маса от атома. Изчисленията показаха, че за да се обяснят експериментите, е необходимо радиусът на атомното ядро да се приеме приблизително равен на 10 -15 μ.
Ръдърфорд предполага, че атомът е подреден като планетарна система. Същността на модела на структурата на атома според Ръдърфорд еследното: в центъра на атома има положително заредено ядро, в което е концентрирана цялата маса, електроните се въртят около ядрото по кръгови орбити на големи разстояния (както планетите около слънцето). Зарядът на ядрото съвпада с номера на химичния елемент в периодичната таблица.
Планетарният модел на Ръдърфорд за структурата на атома не може да обясни редица известни факти:
електрон със заряд трябва, поради силите на привличане на Кулон, да падне върху ядрото, а атомът е стабилна система; когато се движи по кръгова орбита, приближавайки се до ядрото, електронът в атома трябва да излъчва електромагнитни вълни с различни честоти, т.е. излъчваната светлина трябва да има непрекъснат спектър, но на практика се оказва различно:
Електроните на атомите излъчват светлина, която има линеен спектър. Датският физик Нилс Бор е първият, който се опитва да разреши противоречията на планетарния ядрен модел на структурата на атома.
Квантовите постулати на Бор. Излъчване и поглъщане на светлина от атоми. Спектърен анализ
План за реакция
1. Първи постулат. 2. Вторият постулат. 3. Видове спектри.
Бор основава своята теория на два постулата. Първият постулат:една атомна система може да бъде само в специални стационарни или квантови състояния, всяко от които има своя собствена енергия; в стационарно състояние атомът не излъчва.
Това означава, че един електрон (например във водороден атом) може да бъде в няколко добре дефинирани орбити. Всяка орбита на електрон съответства на точно определена енергия.
Вторият постулат:при преминаване от едно стационарно състояние в друго се излъчва или поглъща квант електромагнитно излъчване.Енергията на фотона е равна на разликата между енергиите на атома в две състояния:hv=Em–Εn;h=6,62 • 10 -34 J • s, къдетоh—константата на Планк.
Когато един електрон се движи от близка орбита към по-далечна, атомната система абсорбира количество енергия. Когато се движи от по-отдалечена орбита на електрон към по-близка орбита по отношение на ядрото, атомната система излъчва квант енергия.
Теорията на Бор направи възможно да се обясни съществуването на линейни спектри.
Спектърът на излъчване(или абсорбция) е набор от вълни с определени честоти, които излъчват (или абсорбират) атом от дадено вещество.
Спектрите саплътни, линейнииивици.
Непрекъснатите спектриизлъчват всички вещества, които са в твърдо или течно състояние. Континуумният спектър съдържа вълни от всички честоти на видимата светлина и следователно изглежда като цветна лента с плавен преход от един цвят към друг в този ред: червено, оранжево, жълто, зелено, синьо и виолетово (всеки ловец иска да знае къде седи фазанът).
Линейните спектриизлъчват всички вещества в атомно състояние. Атомите на всички вещества излъчват набори от вълни със съвсем определени честоти, присъщи само на тях. Както всеки човек има свои лични пръстови отпечатъци, така и атомът на дадено вещество има свой, характерен само за него спектър. Линейните емисионни спектри изглеждат като цветни линии, разделени от празнини. Естеството на линейните спектри се обяснява с факта, че атомите на определено вещество имат само свои собствени стационарни състояния със собствена характерна енергия и, следователно, свой собствен набор от двойки енергийни нива, които атомът може да промени, т.е. електрон в атом може да се движи само от една специфична орбита в друга, доста специфични орбити за дадено химично вещество.
Ивичестите спектрисе излъчват от молекули. Изглеждайте раираниспектрите са подобни на линейните спектри, само че вместо отделни линии се наблюдават отделни серии от линии, възприемани като отделни ивици.
Характерно е, че какъвто и спектър да се излъчва от тези атоми, същият се абсорбира, т.е. емисионните спектри съвпадат с абсорбционните спектри по отношение на набора от излъчвани честоти. Тъй като атомите на различни вещества съответстват на спектри, присъщи само натях, има начин да се определи химичният състав на дадено вещество чрез изследване на неговите спектри. Този метод се наричаспектрален анализ.Спектралният анализ се използва за определяне на химичния състав на минерални руди по време на добив, за определяне на химичния състав на звезди, атмосфери, планети; е основният метод за наблюдение на състава на дадено вещество в металургията и машиностроенето.
Фотоелектричен ефект и неговите закони. Уравнението на Айнщайн за фотоелектричния ефект и константата на Планк. Приложение на фотоелектричния ефект в техниката
1. Хипотезата на Планк. 2. Определение на фотоелектричния ефект. 3. Закони на фотоелектричния ефект. 4. Уравнение на Айнщайн. 5. Приложете фото ефект.
През 1900 г. немският физик Макс Планк изказва хипотезата, че светлината се излъчва и поглъща на отделни порции - кванти (или фотони). Енергията на всеки фотон се определя по формулатаE= hν, къдетоh—е константата на Планк, равна на 6,63 • 10 -34 J • s,νе честотата на светлината. Хипотезата на Планк обяснява много явления: по-специално явлението фотоелектричен ефект, открит през 1887 г. от немския учен Хайнрих Херц и експериментално изследван от българския учен А. Г. Столетов.
Фотоелектричният ефект—е явлението на излъчване на електрони от вещество под действието на светлина.
В резултат на изследването са установени три закона на фотоелектричния ефект.
1. Ток на насищане правпропорционална на интензитета на светлинното лъчение, падащо върху повърхността на тялото.
2. Максималната кинетична енергия на фотоелектроните нараства линейно с честотата на светлината и зависи от нейния интензитет.
3. Ако честотата на светлината е по-малка от определена минимална честота, определена за дадено вещество, тогава фотоелектричният ефект не възниква.
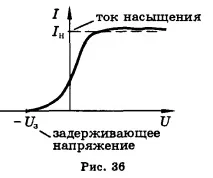
Зависимостта на фототока от напрежението е показана на фигура 36.
Теорията за фотоелектричния ефект е създадена от немския учен А. Айнщайн през 1905 г. Теорията на Айнщайн се основава на концепцията за работата на електроните от метал и концепцията за квантовата светлинна емисия. Според теорията на Айнщайн фотоелектричният ефект има следното обяснение: чрез поглъщане на квант светлина електрон придобива енергияhv.Когато напуска метал, енергията на всеки електрон намалява с определена сума, която се наричаработа(Aout). Работата е работата, необходима за отстраняване на електрон от метал. Максималната енергия на електроните след излизане (ако няма други загуби) е:mv2/2 =hv— Aout,Това уравнение се наричауравнение на Айнщайн.