Електрод от сребърен хлорид - референтен електрод
Референтните електроди трябва да имат възпроизводим потенциал, който е стабилен във времето и не се променя при преминаване на малък ток. Най-често като еталонни електроди се използват електроди от втория вид: сребърен хлорид и каломел.
Електродът от сребърен хлорид е сребърна тел, покрита със слой AgCl и поставена в разтвор на KCl (3M). Активността на сребърните йони в такъв разтвор е:
(1.3)
Замествайки тази стойност в уравнението на Нернст за сребърния електрод, получаваме израза за потенциала на електрода от сребърен хлорид:
(1.4)
Директна потенциометрия
Методите на директната потенциометрия (йонометрия) се основават на директното прилагане на уравнението на Нернст за намиране на активността или концентрацията на участник в електродната реакция от експериментално измерената ЕМП на веригата или потенциала на електрода.
Измерване на pH със стъклен електрод.
Може би най-известното приложение на директната потенциометрия е измерването на pH с помощта на стъклен електрод. Стъкленият електрод (фиг. 1) е тънкостенна стъклена топка 1, пълна с разтвор на HCl или някакъв буферен разтвор 2. Във вътрешността на топката е поставен електрод от сребърен хлорид 3. Това устройство обикновено е покрито със защитна тръба 4.
При контакт с разтвора повърхностният слой стъкло действа като йонообменник, като обменя катиони, разположени в кухините на силикатната рамка, за водородни катиони. За да може мембраната на електрода да придобие тази способност, първо трябва да се накисне в кисел разтвор.
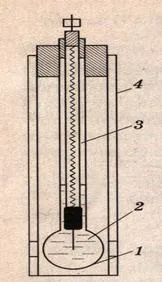
Фиг. 1. стъклен електрод.
Равновесната стойност на потенциала на стъкления електрод зависи от активността на Н + йони ванализиран разтвор (a1) и разтвор на вътрешен електрод (a2). В първото приближение тази зависимост има формата:
(1,5)
Тъй като активността на Н + йони във вътрешния разтвор е постоянна, тогава
(1.6)
Заместване на числените стойности на параметрите и преминаване от логаритми към десетични знаци. При 25°C имаме:
(1,7)
Стойността наEconstзависи от pH стойността на вътрешния разтвор, както и от потенциала на асиметрия на стъклената мембрана, което е потенциалната разлика между двете страни на стъклената мембрана. Възниква поради несъответствието между свойствата на различните страни на мембраната и може да бъде измерено експериментално. Ако от двете страни на мембраната се постави един и същ разтвор.Еconstзависи и от равновесната константа H + (разтвор) ↔ H + (стъкло), която характеризира вида на стъклото и някои други свойства на стъкления електрод. Стандартният потенциал на стъкления електрод обикновено не се определя. Когато се използват фабрично направени pH метри, тази операция се заменя с настройка на инструментите с помощта на стандартни буферни разтвори.
Понастоящем са проектирани стъклени йон-селективни електроди, които са чувствителни към йони на алкални метали Li +, Na +, K +, Rb +, Cs +, както и към Ag +, Tl +, NH4 + йони. Устройството и принципът им на действие са същите като на стъкления pH електрод.
Йон-селективни електроди.
Стъкленият pH електрод е пример за широк клас електроди, наречени йон-селективни. Много ISE, използвани за определяне на различни йони, са проектирани по напълно подобен начин на стъклените. ISE се класифицират според вида на мембраната и се прави разлика между твърди ISE и течни ISE.
Твърдите ISE от своя страна се подразделят на електроди с монокристални и поликристални мембрани.
В ISE с монокристална мембрана йонночувствителният елемент е направен от слабо разтворимо кристално вещество с йонна проводимост. Прехвърлянето на заряд в такъв кристал се дължи на дефекти в кристалната решетка. Свободните места могат да бъдат заети само от йон с определен размер и заряд, което определя високата селективност на монокристалните мембрани. Структурно такива електроди са подобни на стъклените електроди: и в двата електрода мембраните разделят тестовия разтвор и референтния разтвор, който съдържа вътрешен референтен електрод (обикновено сребърен хлорид). Сред електродите от този тип широко се използва флуориден електрод, в който мембраната е LaF3, която има чиста флуоридна проводимост.
ISEs с поликристални мембрани имат недостатъчно стабилен потенциал и тяхната селективност е ниска. В такива електроди мембраната се прави чрез смесване на активното вещество с инертна матрица. От практическо значение е йон-селективен електрод със сребърна сулфидна мембрана, подходящ за измерване на активността както на Ag + -, така и на S 2- йони. На базата на сребърен сулфид са проектирани и различни халогенни и металочувствителни електроди.
Течните ISE имат течна мембрана. В такива електроди референтният разтвор е отделен от анализирания чрез тънък слой от органична течност, съдържаща течен йонообменник, който не се смесва с вода, но селективно реагира с йона, който трябва да се определи. Слой от чувствителна към йони органична течност се получава чрез импрегниране на пореста хидрофобна пластмасова мембрана с тази течност. Електроди от този тип съществуват за Ca 2+ , Na + , K + , NH4 + .
Проектирани са газочувствителни мембранни електроди за определяне на NH3, NO и някои други газове. Напоследък станахашироко използване на филмови електроди, при които се използва тънък филм вместо течна мембрана. Филмовите електроди имат същия механизъм на действие като мембранните електроди, но са по-издръжливи и по-удобни за използване.
1.2.3. Селективност на ISE.
ISE може да се определи количествено с помощта на уравнението на Николски. Той описва зависимостта на потенциала на електрода от концентрацията на чужди йони с помощта на коефициента на селективност. В случай на единичен чужд йон, уравнението на Николски изглежда така:
(1,8)
къдетоаi е активността на определения йон със заряд zi,аj е активността на определения йон със заряд zj, K pot ij е потенциометричният коефициент на селективност.
Като цяло, в присъствието на m интерфериращи йони:
(1,9)
Коефициентът на селективност показва при какво съотношение на концентрациите на определени и чужди йони последният започва да оказва смущаващо действие. Стойностите на коефициентите на селективност варират от много малки стойности. Близо до нула, до едно или повече. Колкото по-малка е стойността на коефициента на селективност, толкова по-висока е селективността на електрода. И така, коефициентът на селективност, равен на 1∙ 10 -3, означава, че чувствителността на електрода по отношение на определени и чужди йони се отнасят като 1000: 1.
Най-предпочитаният метод за определяне на коефициента на селективност е метод, основан на изследване на разтвори, съдържащи смеси от аналита и чужд йон. За целта се получават поредица от калибровъчни зависимости на потенциала на електрода от концентрацията на определяния йон, построени при наличие на различни концентрации на чужд йон (фиг. 2).
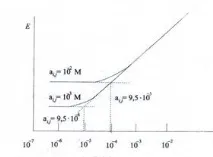
Фиг.2. Определяне на коефициента на селективност на ISE от построените калибровъчни зависимостив присъствието на чужди йони с концентрация 10 -2 М (горна графика) и 10 -3 М (долна графика). В този случай коефициентът на селективност е равен на 9,5 ∙ 10 -3 .
При големи излишъци на чужди йони потенциалът на електрода се определя от втория член в уравнението на Николски. Той остава постоянен и не зависи от концентрацията на йона, който трябва да се определи (хоризонтален участък на калибровъчната крива). От абсцисата на точката на пресичане на два участъка от калибровъчната зависимост - хоризонтална и наклонена - равна наai =Kij pot ∙aj z ( i )/ z ( j ) ,, като знаете постоянната стойностaj,, можете да изчислите коефициента на селективност. Описаният метод по принцип дава възможност да се изчисли коефициентът на селективност дори от една зависимост на калибриране, но за по-голяма надеждност трябва да се използват няколко.