Етери
Етерите (естери) са съединения с обща формула ROR'. Според номенклатурата на IUPAC, етерите се считат за алкоксиалкани. В този случай по-големият радикал се счита за основен. За етери, по-често, отколкото за други класове съединения, се използва радикално-функционалната номенклатура. В този случай имената се образуват от имената на радикалите R и R’, свързани с кислородния атом, добавяйки думата "етер":
или или
(диетилов етер) (трет-бутил метилов етер, TBME)
Целозолвът и метилцелозолвът са добри протични разтворители за реакции. Добър разтворител за провеждане на реакции на хидробориране и за редукция с натриев хидроборат е диглимът.
2-метоксиетанол 2-етоксиетанол диетилен гликол диетилов етер
(метил целозолв) (целозолв) (диглим)
Цикличните етери се използват широко:
етилен оксид тетрахидрофуран тетрахидропиран 1,4-диоксан
Етерите имат същата геометрия като H2O (Gillespie). Ъгълът на връзката C-O-C съответства на 112 o за CH3OCH3, което е близо до тетраедричния ъгъл и показва sp3 хибридизация на кислородния атом.
Етерните молекули не могат да образуват водородни връзки помежду си и затова са много по-летливи от алкохолите със същия брой въглеродни атоми. Плътността на етерите е по-малка от тази на водата. Разтворимостта им във вода, с която могат да образуват водородни връзки, е почти същата като тази на техните изомерни алкохоли, например диетилов етер и 1-бутанол се разтварят във вода в количество около 8 g на 100 ml вода.
Естерите са химически доста инертни и затова се използват широко като разтворители. Много естери имат приятна миризмаи се използват в парфюмерията.
(a B C)
(г) (д)
(a) 2-метокси-2-метилпропаний (трет-бутилметилов етер), (b) 2-метокси-2-метилпропани (трет-бутилетилов етер), (c) транс-2-етоксициклохексанол, (d) метоксиетен (винилметилов етер).
Краун етери. Концепции за междуфазна катализа
Краун етери (по-точно краун полиестери) са макроциклични полиестери, съдържащи няколко кислородни атома в цикъла. Формално те могат да се разглеждат като продукти на циклоолигомеризацията на етиленовия оксид. В имената на коронните етери първата цифра показва размера на пръстена, а втората определя броя на кислородните атоми в пръстена.
Уникалното свойство на краун етерите е способността да образуват комплекси със соли на алкални метали. Тези комплекси се получават чрез електростатично взаимодействие.
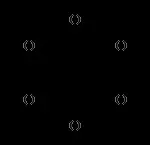
15-краун-5 18-кроун-6 дициклохексан-18-кроун-6
Способността за комплексообразуване се проявява още при синтеза на краун етери. И така, когато смес от триетилен гликол и дихлорида (хлорекс), получен от него, се третира с калиев хидроксид, техните молекули се координират в пространството по такъв начин, че циклизацията става възможна:

Добивът на краун етери зависи много силно от природата на основния катион. Най-високият добив на 18-краун-6-полиетер се постига при използване на калиеви алкохолати. Това показва, че катионът играе ролята на матрица при образуването на цикъла. Размерът на пръстена се определя от координационното число на катиона на алкалния метал. Координационното число K + по отношение на съдържащите кислород лиганди е шест, така че калиевият катион е най-ефективен при получаване на 18-краун-6-полиетер с шест кислородни атома в цикъла.
Получено е влиянието на катиона върху размера на образувания пръстенимето на матрицата или ефекта "шаблон". Crown полиестерите взаимодействат с катиони домакин-гост:
 |  |
Краун полиестерите образуват стабилни комплекси с преходни и непреходни метални катиони. Стабилността на тези комплекси зависи от съответствието на диаметъра на катиона с размера на пръстенната кухина, както и от координационното число на металния катион.
йон Li + Na + K + Rb + Mg + Ca +
диаметър, мм 136 194 266 294 164 286
(пикометър; 1 pm = 10 -12 m или 1 pm = 0,01Å)
Краун полиестерите правят различни соли разтворими в неполярни разтворители. Соли като KF, KCN и CH3COOK могат да бъдат прехвърлени в апротонни разтворители с помощта на каталитични количества от 18-краун-6 и тези соли могат да участват в реакции на нуклеофилно заместване с органични субстрати:
(29)
В тези реакции 18-краун-6 действа като катализатор за фазов трансфер. Преминаването на реагент от една фаза в друга (обикновено от течна или твърда неорганична към течна органична) се нарича междуфазна катализа, а краун етерите се наричат межфазови трансферни катализатори.
Етерни реакции
Етерите са сред нискореактивните вещества и са стабилни по отношение на много реагенти, особено основни. Поради това те се използват широко като разтворители. Разтварящата сила на етери като разтворители се основава на свойствата им като твърди бази на Люис. Като твърди основи те образуват силни комплекси с реактиви на Гриняр, органолитиеви съединения, съдържащи твърди киселини, магнезиеви или литиеви катиони.
Основни свойства на проститеетери
Тъй като кислородният атом има висока електроотрицателност и ниска поляризуемост, етерите са слаби бази на n-Брьонстед и твърди бази на Люис. По същата причина те са в състояние да образуват оксониеви соли в безводна среда само със силни киселини на Бренстед (сярна киселина, халогеноводороди) и взаимодействат с твърдите киселини на Пиърсън - алуминиеви, цинкови, калаени (IV) хлориди; борен трифлуорид. Като твърди бази на Луис, естерите образуват много силни комплекси с твърди киселини на Люис - BF3, AlBr3, AlR3, SbCl5, SbF5, SnCl4, ZnCl2 и др. състав 1:1 или 1:2:
Основните свойства на естерите обясняват добрата им разтворимост в киселини:
(9)
(10)
Като бази на Люис етерите образуват комплекси с халогени, в които етерът играе ролята на донор, а халогенът е акцептор на електронна двойка. Разтворът на йод в етер е оцветен в кафяво, за разлика от виолетовия цвят на йода в алканите.
d-d+
Такива комплекси се наричат комплекси за пренос на заряд (CTC).
Киселинно разцепване на етери
Под действието на халогеноводородни киселини естерите се разцепват чрез междинни оксониеви соли:
(единадесет)
(M 4)
С излишък на HBr алкохолът се превръща във втора молекула етил бромид:
(12)
Киселинното разцепване на етери трябва да се разглежда като типичен случай на реакция на нуклеофилно заместване при наситен въглероден атом. В зависимост от природата на алкиловите групи, свързани с кислорода, се реализира SN2- или SN1-механизмът. Разцепването изисква силни киселини и добри нуклеофили HI (57%) и HBr (48%). Конц. HCl (38%) е най-малко ефективен, тъй като Cl - във водата е по-слаб нуклеофил от Br - и I -.
Третичните алилови и бензилови естери са особено склонни към разцепване. Третичният бутилов етер се разцепва от солна киселина при нормална температура по механизма SN1:
(13)
Радикални реакции на етери
Подобно на алканите, етерите претърпяват радикално халогениране, но халогенирането на етери е силно региоселективно и се среща в a-позиция по отношение на кислородния атом:
(14)
Хлорният атом в а-хлоретерите е много подвижен и може лесно да бъде заменен.
Етерите са способни да се окисляват от атмосферния кислород и, когато са изложени на въздух за дълго време, в тях се натрупват хидропероксиди, например:
(15)
Пероксидите се разрушават от натрий, соли на желязо (II) или манган (II).