Гъбични микози (ГМ) - класификация, диагностика, лечение, прогноза
Mycosis fungoides(MF) е описан за първи път от френския дерматолог Alibert през 1806 г. Mycosis fungoides представлява по-голямата част от Т-клетъчните кожни неходжкинови лимфоми - 85-90%. Mycosis fungoides получи името си поради появата на кожата на "гъбени" образувания, които засягат различни части на кожата. Mycosis fungoides е рядка форма на неходжкинови лимфоми и представлява само 2-3% от всички лимфоми. Заболеваемостта в САЩ е 0,29 на 100 хиляди и е приблизително 2 пъти по-висока в Западна Европа. Средната възраст на пациентите е 55-60 години, мъжете боледуват 2 пъти по-често от жените. Причината за GM не е напълно ясна.
B.Poieszпрез 1980 г. изолира вируса HTLV-1 от туморната тъкан и периферната кръв на пациент с гъбична микоза. Сега е добре известно, че почти всички пациенти с mycosis fungoides HTLV-1 са серонегативни, но въпреки това наличието на вируса в мононуклеарните клетки на кожните туморни огнища е установено чрез PCR, което предполага етиологичното значение на HTLV-1. Това мнение обаче не се споделя от всички изследователи. V. Manzari откри друг ретровирус (HTLV-V) при 7 пациенти с микоза фунгоиди, чиято роля се проучва интензивно в момента.
Морфологичната проверка наmycosis fungoidesе трудна, следователно имунофенотипирането е от голямо значение при mycosis fungoides: в повечето случаи се отбелязва CD2+-, CD3+-, CD4+-фенотип, докато други антигени на зрели Т-клетки отсъстват. Много рядко CD8+ се открива при mycosis fungoides.
Фунгиформната микозасе развива бавно, преди диагнозата да отнеме 5 или повече години. Специфични папули или екзематозни огнища могат да бъдат разположени на всяка част на кожата, понякога те са симетрични. алопеция- следствие от увреждане на скалпа. Сърбежът по кожата се появява рано, упорит е и често е основна причина за посещение при лекар. Папулозните образувания постепенно се трансформират в тумори, последвани от улцерация и инфекция. Именно тази клинична форма на гъбична микоза е описана от Alibert.
Друга проява нафунгоидна микозае еритродермията, придружена от силен сърбеж и непоносимост към студ. При еритродермия се развива лимфаденопатия, в периферната кръв се появяват атипични туморни клетки, подобни на клетките на туморните кожни инфилтрати във всички биомолекулярни характеристики. При всеки първоначален обем на кожни лезии, следващият етап в прогресията на микозата fungoides е появата на екстракутанни лезии: увеличаване на предимно периферните лимфни възли, обикновено регионални по отношение на най-засегнатата област на кожата. Медиастиналните и абдоминалните лимфни възли се включват в процеса само в крайния стадий на развитие на заболяването. Последни се появяват висцералните огнища (в белодробната тъкан, горните дихателни пътища, централната нервна система, черния дроб).
TNMB класификация на mycosis fungoides
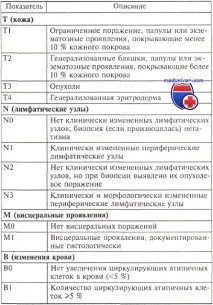
Тазикласификацияе адаптирана към клинично стадиране.
Клинична класификация на фунгоидната микоза
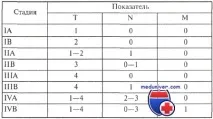
10-годишнатапреживяемост при Т1 е 97%, при Т2 - 77%, при Т3-Т4 - 50%.
ПриIA стадийна mycosis fungoides, основните терапевтични ефекти са локални методи: локално инжектиране на ембихин (HN2) в туморни огнища, използван за първи път от K. Van Scott и M. Kalmanson през 1973 г., PUVA терапия (дълговълново ултравиолетово облъчване с фотосенсибилизатор) и локално облъчванеелектрони на туморна лезия, които правят възможно постигането на PR съответно от 60, 78, 75%. 5-годишен курс без рецидив с електронно облъчване е очевидно по-често срещан (60% в сравнение с 40% с embiquine), който става все по-често срещан.
Embikhinсе прилага интратуморно като воден разтвор в концентрация 10-20 mg/dl поне веднъж дневно до пълна резорбция на лезиите. При бавен ефект, дозата може да се увеличи до 40 mg на ден. Локална нежелана реакция може да бъде развитието на еритема на интактната кожа около тумора. Друг вариант на локалния ефект е интратуморното приложение на BCNU, чийто начин на използване е разработен, но не е приложен на практика.
ПриIBиIIA стадиис генерализирани кожни лезии (T2), туморите трябва да бъдат изложени на електронно облъчване. Добавянето на embiquine леко повишава процента на пълните ремисии (62% в сравнение с 49%), но не влияе на процента на 5-годишните пълни ремисии (17 и 14%) и 10-годишната преживяемост (54 и 50%).
ПриIIB стадийводещата терапия е IFN-a под формата на монотерапия или в комбинация с PUVA и ретиноиди. Ежедневната употреба на IFN-a в доза от 5-10 IU / m2 в продължение на 4-8 седмици, последвана от продължително приложение на лекарството 2-3 пъти седмично (до постигане на максимален отговор) позволява получаване на пълна ремисия при повече от 40% от пациентите; 5- и 10-годишната преживяемост е 44% и 28% (съответно). Клиничната картина на кожната еритродермия (Т4) също предполага необходимостта от IFN-a, PUVA и ретиноиди. Продължителността на терапията се определя от ефекта.
Генерализиран процес(етапи III и IV), подложен на химиотерапия (CHOP, флударабин,пентостатин) в комбинация с локално приложение на ембихин.
Вторатацел на лечениетое да се предотврати развитието на инфекциозни усложнения в засегнатите области и прилежащите кожни участъци. Още на етап IA се препоръчва стероидна профилактика на кожна инфекция с такъв патоген като Borrella. Добавянето на инфекциозни усложнения на всеки етап от развитието на заболяването диктува необходимостта от използване на тропични антибиотици в комбинация с въздействието върху алергичния кожен компонент.
Други варианти на първичникожни неходжкинови лимфомиса изключително редки. Лечението на прогностично благоприятни центрофоликуларни В-клетъчни, Т-големи клетъчни CD30+ тумори се извършва съгласно принципите на терапията на индолентни неходжкинови лимфоми. Т-клетъчният анапластичен голям клетъчен тумор е силно агресивен и трябва да бъде интензивно медикаментозно лекуван с включване в комбинация, по-специално метотрексат, цисплатин.