Използването на хормонална терапия при генерализирана форма на рак на гърдата
През последните години заболеваемостта от рак непрекъснато нараства, а смъртността от злокачествени новообразувания също нараства, въпреки всички усилия на съвременната медицина. В последните, терминални етапи от развитието на раковия процес, употребата на химиотерапевтични лекарства е съмнителна и опасна поради възможността за токсично увреждане на тялото, следователно използването на хормонална терапия изглежда най-успешното, безопасно и обещаващо в този случай. В тази статия ще разгледаме използването на хормонална терапия при генерализирана форма на рак на гърдата.
Защо хормонална терапия? Отговорът на този въпрос може да бъде получен, ако внимателно прочетете съвременната класификация на средствата и ефектите, използвани в онкологията.
Класификация на терапевтичните средства и ефекти, използвани в онкологията.
ЛЕКАРСТВА ВЪЗДЕЙСТВУВАЩИ НА ТУМОРА
1. Основно лечение Хирургия Лъчетерапия Химиотерапия Хормонална терапия 2. Подобрители Хипертермия Оксигенация Диуретици Мембрани
ЛЕКАРСТВА ВЪЗДЕЙСТВУВАЩИ НА ОРГАНИЗМА
1. Патогенетични агенти, действащи на ниво: А) Регулаторни системи Медиатори Хормони Имунорегулатори Б) Тъкан Хипоксия Простагландини В) Метаболизъм Антиоксиданти Микроелементи Витамини Ензими 2. Антитоксични Хемостимулатори Диуретици 3. Симптоматични Сърдечно-съдови Болкоуспокояващи Противовъзпалителни
И така, от тази класификация виждаме, че хормоналната терапия се използва много често при туморния процес. Като се има предвид, че с генерализирана форма на рак, употребатанякои компоненти на първия параграф (основно лечение) е невъзможно, тогава остава само използването на хормонална терапия.
За да разберем как точно действат хормоните върху раковата клетка, нека разгледаме механизма на злокачествена трансформация на туморна клетка. Определен SRC ген взаимодейства в клетка с трансформиращ протеин, който обикновено се съдържа в нея. Резултатът от това взаимодействие е образуването на трансформиращ растежен фактор. Трансформиращият растежен фактор, произведен от клетката, характеризира възобновяването (или по-точно увеличаването) на автокринната хормонална секреция, проявяваща се в инсулинизацията на мембраната. (Вероятно инсулинът поддържа базалната енергия във всички тъкани, докато отделно за клетките на всяка тъкан има свой специфичен растежен фактор). Това води до увеличаване на транспорта на глюкоза и аминокиселини (както и други вещества) в клетката, което осигурява нуждите на клетката от енергия и пластмасови материали. Увеличаването на навлизането на глюкоза в клетката също причинява намаляване на нивото на цикличния AMP в клетката, което от своя страна е свързано с механизъм за увеличаване на синтеза на холестерол и този последен ефект е свързан със синтеза на ДНК и клетъчното делене.
SRC ген + трансформиращ протеин (начален етап)
Образуване на TGF и мембранна инсулинизация (етап на промоция)
навлизане на глюкоза и аминокиселини в клетката
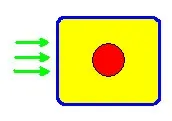
намаляване на нивата на сАМР и увеличаване на синтеза на холестерол
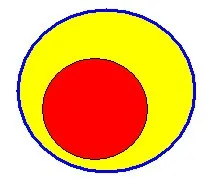
стимулиране на синтеза на ДНК и клетъчното делене на раковата клетка
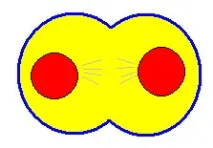
В реалните условия на развитие и съществуване на злокачествени тумори те интензивно абсорбират глюкоза (което позволява да се определи злокачествен тумор като „капан за глюкоза и азот“ - Shapot V.S., 1975) и натрупват лактат (това показва, четранспортирането на глюкоза в трансформираната клетка далеч надвишава енергийното използване на глюкозата в пентозния цикъл и в цикъла на Кребс и следователно този транспорт (т.е. приемът на глюкоза) не се инхибира от механизма на клетъчното делене). Също така трябва да се отбележи, че нивото на холестерола в туморната клетка се повишава значително, което индиректно увеличава скоростта на клетъчно делене (поради увеличаване на липопротеините с ниска плътност в мембраната и увеличаване на скоростта на абсорбция на "строителни" вещества).
Разгледахме механизма на трансформация на злокачествена клетка. Нека сега да разгледаме защо е невъзможно да се използват хирургични методи за лечение в генерализираната форма на туморния процес. И така, при значителна туморна лезия на млечните жлези, обикновено вече има метастази в други органи. И следователно, по време на операции от този вид, има увеличение на техния растеж. Това е наречено „експлозивната сила на рака“. Това сериозно усложнение на хирургичния метод на лечение първоначално се обяснява с масовото навлизане на туморни клетки в кръвта по време на операцията. Въз основа на това Н.Н. Петров разработва принципите на абластика и антибластика през 50-те години, които са актуални и днес. Това е цяла система от мерки, включително най-щадящото отношение към тумора по време на операцията, както и възможния радикализъм на операцията. Изследвания за откриване на туморни клетки в кръвта показват, че наистина, ако се спазват правилата на абластика, броят на туморните клетки в кръвта е по-малък. Това обаче не повлия значително на броя на метастазите. Всичко това доведе до теорията за "спящите" ракови клетки, които под въздействието на редица фактори започват своя бърз растеж. Експериментално е потвърдено наличието на спящи клетки. Това са клеткитев етапа на иницииране (виж модела на злокачествена трансформация на туморна клетка). Като се има предвид всичко това, може да се предположи, че наличието на дълъг интервал между началото и развитието на туморния процес може до известна степен да се дължи на „неподходящ” или, с други думи, нормален метаболитен фон. Когато например под въздействието на стрес, операции и др. този фон се измества, тогава се насърчава туморният процес. В това отношение, тромбоцитният растежен фактор заслужава специално внимание, който се освобождава в околната среда по време на тромбоцитната агрегация (по време на операция). Стимулира пролиферацията на клетките в редица тъкани, като под негово влияние се увеличава както синтезата на холестерол, така и броят на рецепторите за липопротеини с ниска плътност. Вероятно това е причината тромбоцитният растежен фактор да стимулира растежа на метастазите.
Сега помислете за ефектите от химиотерапията върху тялото.
Известно е, че пролифериращите клетки преминават последователно през 2 фази на клетъчния (митотичен) цикъл: митоза (деление) и подготовка за нея (интерфаза). Интерфазата се състои от няколко фази: постмитотична фаза (G1) или постмитотична фаза на покой, фаза на синтез на клетъчна ДНК (S) и предмитотична фаза (G2). Общата продължителност на митотичния цикъл на бластните клетки е около 80 часа.

Според ефекта върху клетъчната кинетика всички лекарства могат условно да се разделят на две групи: 1) специфично действащи върху клетъчния цикъл - S-фаза-специфични, свързани с инхибитори на синтеза на ДНК; 2) циклонеспецифични, нарушаващи структурата на клетката на всеки функционален етап (алкилиращи съединения). Ефективността на цитостатичната терапия е толкова по-висока, колкото повече фази от клетъчния цикъл са под контрола на цитостатиците (следователно,множество лекарства). При лечението на рак на гърдата най-често и най-успешно се използва химиотерапевтичният режим на Cooper: циклофосфамид, метотрексат, 5-флуороурацил, винкристин, преднизолон или неговата опростена модификация - циклофосфамид, метотрексат, 5-флуороурацил (CMF), ефективността е същата.
Има данни, че химиотерапията е ефективна при наличие на микрометастази (до 1 милион клетки) с ефективност до 99%. Но никога не трябва да забравяме за недостатъците на химиотерапията: усложнение е увреждане на имунологичния статус на тялото, свързано с дисфункции, предимно на хематопоетичната и ендокринната система. Има два фактора, които трябва да имат ограничаващ ефект върху всички видове цитотоксична химиотерапевтична терапия. Според редица изчисления цитотоксичните лекарства не могат да причинят смъртта на всички туморни клетки, докато крайният успех на лечението зависи от смъртта на последната туморна клетка. В същото време точно цитотоксичните лекарства могат да увредят тези противотуморни системи на тялото, чиято активност, напротив, трябва да се активира за пълното елиминиране на раковите клетки.
Хормонална терапия.
По принцип съществуват три типа хормонални ефекти върху развитието на тумори: адитивни (допълнително приложение на хормони, включително тези от противоположния пол, в дози, надвишаващи физиологичните), аблативни (потискане на образуването на хормони) и антагонистични (блокиране на действието на хормоните на клетъчно ниво). Абластичният ефект се осъществява чрез хирургично отстраняване на една или друга ендокринна жлеза, облъчване на жлезите, както и фармакологични ефекти - използване на инхибитори на андрогени, естрогени, кортикостероиди. Границите между посочените видове хормонална терапия вдо известна степен условно.
Най-често използваните адитивни и абластични ефекти. Тамоксифен има антагонистичен ефект (конкурентно се свързва с естрогенните рецептори).
В зависимост от нивото на действие, ефектът от хормоналната терапия може да бъде централен (потискане на производството на тропни хормони на хипофизата), периферен (намаляване на производството на хормони в периферните ендокринни жлези) и клетъчен. Глюкокортикоидите се използват при рак на гърдата за потискане на производството на андрогени и естрогени в надбъбречните жлези. То е толкова ефективно, колкото и адреналектомия. Това се дължи на факта, че глюкокортикоидите в тъканите инхибират пролиферацията и е известно, че имат антиинсулинов ефект (т.е. намаляват инсулинизацията на мембраната и доставката на хранителни вещества към туморната клетка).
На практика използвахме преднизолон в доза от 30 mg/m2 2 пъти дневно в продължение на 10 дни, след което дозата беше намалена до 10 mg/m2 2 пъти дневно в продължение на 10 дни, след което дозата отново беше намалена до 5 mg/m2 дневно в продължение на 10 дни. Извършено е наблюдение на 16 животни, 9 кучета от различни породи и 7 котки. Всички животни са били на възраст над 10 години и са имали множество неоперабилни лезии на млечните жлези. 5 животни са имали значителни метастази в други органи (бели дробове, кости). Въвеждането на хормони се извършва под контрола на клиничен кръвен тест. Всички животни се характеризират с повишена ESR, намаляване на нивото на хемоглобина и броя на еритроцитите, увеличаване на броя на левкоцитите и изместване на левкоцитната формула вляво от видовете дух - неутрофилия с хипорегенеративно изместване и неутрофилия с хиперрегенеративно изместване. При определяне на левкограмата се вземат предвид дегенеративните промени в левкоцитите: в някои случаи наличието на пикноза или хиперсегментацияядра, появата на токсична грануларност и вакуолизация.
Данните от анамнезата бяха взети под внимание: в 11 случая собствениците отбелязаха подобрение на общото благосъстояние, намаляване на отока и възпалителна реакция около туморния възел, значително повишаване на апетита, намаляване на болката (субективно), признаци на еуфория (често се отбелязва в хуманната медицина при продължителна хормонална терапия).
Най-важното явление е намаляване на скоростта на прогресиране на туморния процес (продължителност на наблюденията 1 година). При 5 животни не се наблюдава положителна динамика. Леки стомашно-чревни смущения са наблюдавани при 3 животни. Отделно, на 3 животни (кучета) беше приложен преднизолон съгласно горната схема (в низходящ ред) при доза, започваща от 15 mg/m2 в комбинация с тамоксифен в доза от 10 mg/m2 два пъти на ден. Това се дължи на повишената антиестрогенна активност на тамоксифен. В резултат на това: липса на прогресия на тумори (2 живи), намаляване на размера на тумора (1 жив с диагноза аденокарцином на отноинфилтративна форма), липса на изразени странични ефекти. Интересно е да се използват лекарства, които намаляват производството на естроген - ароматазни инхибитори от първо поколение (mamomit). Цената на тези лекарства обаче затруднява използването им в широка ветеринарна практика.
Въздействието върху невроендокринната система значително ще повлияе на скоростта на растеж на тумора и ефективността на противотуморната терапия. В същото време нормализирането на хормоналния баланс се счита за един от важните елементи на патогенетичната терапия на злокачествените новообразувания.
По този начин регулирането на неврохормоналната връзка е важен аспект в комплексната терапия на злокачествени новообразувания. Трябва да се отбележи обаче, че за дахормоналната корекция изисква ясно познаване на ендокринния статус на всеки отделен пациент. Само в този случай ще бъде възможно да се говори за истинска коригираща хормонална терапия.