Изследване на параметрите на АТФ-зависимия транспорт на К в МС на сърцето на черния дроб на плъх с различна резистентност
В работата бяха определени параметрите на АТФ-инхибираното енергозависимо навлизане на К+ в MX при плъхове с различна резистентност към хипоксия, както и плъхове с ниска резистентност след адаптирането им към интервално нормобарно хипоксично обучение. Както следва от Фигура 9А, скоростта на навлизане на K+ в MC на силно резистентни плъхове е значително по-висока, отколкото в MC на животни с ниска устойчивост.
Фигура 9. Скоростта на енергийно зависимо навлизане на K+ в MC на черния дроб и сърцето на плъхове с различна устойчивост на хипоксия (A), както и в MC на животни, адаптирани към хипоксия B
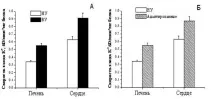
NU - ниско устойчиви, VU - силно устойчиви животни. Концентрацията на протеин МХ в клетката е 0,1 mg/mL. Инкубационна среда: 50 mM KCl, 5 mM HEPES, 5 mM NaH2PO4, 5 mM янтарна киселина, 0.5 mM MgCl2, 0.1 mM EGTA, 5 µM цитохром С, 2 µM ротенон, 1 µM циклоспорин А, рН 7.2. Подуването се инициира чрез добавяне на МН.
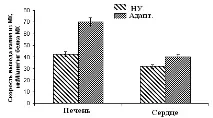
Фигура 10. Скорост на DNP-индуцирано освобождаване на K+ йони от MX животни с висока, ниска поносимост към хипоксия и с ниска поносимост на животни, адаптирани към хипоксия
VU - силно устойчиви плъхове, NU - ниско устойчиви, Adapt. - нискоустойчиви, адаптирани към хипоксия. Измерванията се извършват при постоянно разбъркване и контрол на температурата при 26°С. Концентрацията на протеин MX в клетката е 1,5–2 mg/mL. Инкубационната среда съдържа: 0.3 М захароза, 3 mM NaH2PO4, 10 mM Tris-HCl, рН 7.4.
Хипоксичното обучение води до увеличаване на скоростта на енергийно зависим вход на K + до ниво, сравнимо с това на силно устойчиви плъхове (фиг. 9B).
Тези данни корелират с резултатите от изследването на DNP-индуцираното АТФ-зависимо освобождаване на K + от MC, измерено с помощта на K + -селективен електрод (фиг. 10).
Трябва също да се отбележи, че адаптирането води до промянапараметри на инхибиране на ATP канал. Установено е, че Ki за АТФ в сърдечния mitoKATP е значително по-нисък при адаптирани и силно устойчиви животни в сравнение с ниско устойчиви животни (Таблица 1), което е доказателство за по-фина регулация на K + транспорта по време на адаптацията на плъхове към хипоксия.
Таблица 1. Константа на инхибиране на АТФ на енергозависимото влизане на К+ в МС на сърцето и черния дроб на плъхове с различна резистентност към хипоксия, както и при тези, адаптирани към хипоксия
Устойчивост на хипоксия
* Разликите са значителни при p + , но също и при активирането на K + / H + -обменника, който регулира освобождаването на калиеви йони от MX.
Освобождаването на калий от MCh по време на адаптирането на животните към хипоксия поради интензификацията на K + / H + обменника при активиране на mitoKATP прави възможно поддържането на постоянен обем на MCh и вероятно е необходимо за адаптирането на животните към хипоксия.
Възможно е по време на адаптирането на нискоустойчиви животни към хипоксия да е важно активирането не само на системата за АТФ-зависимо навлизане на К + в митохондриите, но и на системата за изход на този йон. В същото време намаляването на активността на K+/H+ обменника може да бъде причина за високоамплитудно подуване, последвано от увреждане на MCh по време на исхемия.

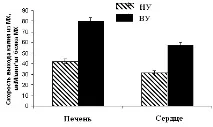
Фигура 11. Количеството K+ в сърдечния MC на плъхове с различна резистентност (A) и тези, адаптирани към хипоксия (B)
Измерванията се извършват при постоянно разбъркване и контрол на температурата при 26°С. Условия като на фиг. 10.
Известно е, че при хипоксия липсата на кислород води до възстановяване на носителите на дихателната верига, тъй като потокът от електрони към кислорода е затруднен (Лукянова, 2004).
В съответствие с литературните данни, намаляването на носителите, локализирани в комплекси I и III на дихателната верига, води до увеличаване на образуването на реактивни кислородни видове (ROS)[Каплан-Бреслер, 1965; Ferranti et al., 2003]. Както беше показано по-рано, основното място на образуване на ROS са свързани с протеин убисемихинони, които са спин-конюгирани с клъстера желязо-сяра [Ohnishi et al., 2005].
MChs превръщат няколко процента от консумирания кислород в ROS [Lenaz et al., 2002]. Както беше показано по-рано, за функционирането на дихателната верига са необходими ниски концентрации на ROS [Кондрашова и Миронова, 1971]. В същото време повишеното образуване на ROS по време на хипоксия е основният увреждащ фактор [Starkov et al., 1997; Barger et al., 2002].
Активирането на калиевия цикъл, което открихме, допринася за слабо разединяване на митохондриите и намаляване на мембранния потенциал. Известно е, че леко намаляване на мембранния потенциал (
13%) води до значително намаляване на производството на ROS (до 80%) [Korshunov et al., 1997]. Освен това беше установено, че активирането на канала е придружено от намаляване на концентрацията на ROS в клетката, допринасяйки за поддържането на нивото на АТФ [Zweier et al., 1987; Pain et al., 2000].
Този предложен механизъм може да обясни защитната роля на mitoKATP канала по време на реперфузия. Добре известно е, че ROS са основният увреждащ фактор по време на исхемия/реперфузия [Pearlstein et al., 2002; Li et al., 2002], а активирането на mitoKATP канала води до намаляване на нивото на производство на ROS по време на фазата на реперфузия [Zweier et al., 1987; Ozcan et al., 2002]. Получените данни потвърждават разработените в лабораторията на проф. Концепцията на Лукянова, че адаптирането към хипоксия възниква на фона на намаляване на активността на свободните радикали, а не на нейното увеличаване [Lukyanova, 2004].
По този начин резултатите, получени в работата, позволиха да се докаже важната роля на mitoKATP във формирането на устойчивостта на организма към кислороден глад, както ипри адаптирането на животните към хипоксия. В статията се предлага и възможен механизъм за формиране на този тип адаптация.