Класификация и номенклатура на аминокиселините
Обща характеристика (структура, класификация, номенклатура, изомерия).
Основната структурна единица на протеините са а-аминокиселините. В природата се срещат около 300 аминокиселини. В състава на протеините са открити 20 различни a-аминокиселини (една от тях, пролинът, не еамино-, аиминокиселина). Всички други аминокиселини съществуват в свободно състояние или като част от къси пептиди или комплекси с други органични вещества.
а-аминокиселините са производни на карбоксилни киселини, в които един водороден атом е заменен с аминогрупа (–NH2) при а-въглеродния атом, например:
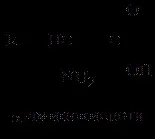
Аминокиселините се различават по структурата и свойствата на радикала R. Радикалът може да представлява остатъци от мастна киселина, ароматни пръстени, хетероцикли. Поради това всяка аминокиселина е надарена със специфични свойства, които определят химичните, физичните свойства и физиологичните функции на протеините в тялото.
Благодарение на аминокиселинните радикали протеините имат редица уникални функции, които не са характерни за други биополимери, и имат химическа идентичност.
Много по-рядко в живите организми има аминокиселини с b- или g-позиция на аминогрупата, например:
Класификация и номенклатура на аминокиселините.
Има няколко вида класификации на аминокиселини, които изграждат протеин.
A) Една от класификациите се основава на химическата структура на аминокиселинните радикали. Аминокиселините се разграничават:
1. Алифатни - глицин, аланин, валин, левцин, изолевцин:

2. Хидроксил-съдържащи - серин, треонин:

3. Съдържащи сяра - цистеин, метионин:

4. Ароматни -фенилаланин, тирозин, триптофан:


6. и амиди на аспарагиновата и глутаминовата киселини - аспарагин, глутамин.
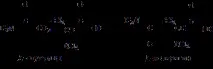
7. Основните са аргинин, хистидин, лизин.

 |
B)Вторият тип класификация се основава на полярността на R-групите на аминокиселините.
Имаполярни и неполярни аминокиселини. Неполярните радикали имат неполярни C-C, C-H връзки, има осем такива аминокиселини:аланин, валин, левцин, изолевцин, метионин, фенилаланин, триптофан, пролин.
Всички други аминокиселини саполярни (R-групата има полярни C–O, C–N, –OH, S–H връзки). Колкото повече аминокиселини с полярни групи има в един протеин, толкова по-висока е неговата реактивност. Функциите на протеина до голяма степен зависят от реактивността. Ензимите се характеризират с особено голям брой полярни групи. Обратно, има много малко от тях в такъв протеин като кератин (коса, нокти).
B) Аминокиселините също се класифицират въз основа на йонните свойства на R-групите (Таблица 1).
Киселинни (при pH=7 R-групата може да носи отрицателен заряд) това са аспарагинова, глутаминова киселини, цистеин и тирозин.
Основни (при pH=7, R-групата може да носи положителен заряд) са аргинин, лизин, хистидин.
Всички други аминокиселини са класифицирани катонеутрални (R групата е незаредена).
Таблица 1 - Класификация на аминокиселини въз основа на полярността на R групите.
4. Положително заредени R-групи
D)Според броя на аминните и карбоксилните групи аминокиселините се делят на:
–в моноаминомонокарбоксилнасъдържаща една карбоксилна и една аминова група всяка;
– моноаминодикарбоксилна(две карбоксилни и една аминова група);
– диаминомонокарбоксилна(две аминогрупи и една карбоксилна група).
E) Според способността да се синтезират в човешкия и животинския организъм, всички аминокиселини се делят на:
–за взаимозаменяеми,
Незаменимите аминокиселини не могат да се синтезират в организма на човека и животните, те трябва да се доставят с храната. Има осем абсолютно незаменими аминокиселини:валин, левцин, изолевцин, треонин, триптофан, метионин, лизин, фенилаланин.
Частично незаменими - синтезирани в тялото, но в недостатъчни количества, следователно те трябва частично да идват от храната. Такива аминокиселини саарганин, хистидин, тирозин.
Неесенциалните аминокиселини се синтезират в човешкото тяло в достатъчни количества от други съединения. Растенията могат да синтезират всички аминокиселини.
Изомерия
В молекулите на всички естествени аминокиселини (с изключение на глицина) при а-въглеродния атом всичките четири валентни връзки са заети от различни заместители, такъв въглероден атом е асиметричен и се наричахирален атом. В резултат на това аминокиселинните разтвори имат оптична активност - те въртят равнината на плоскополяризираната светлина. Брой възможниима точно 2 n стереоизомера, където n е броят на асиметричните въглеродни атоми. Глицинът има n = 0, треонинът има n = 2. Всички останали 17 протеинови аминокиселини съдържат по един асиметричен въглероден атом, те могат да съществуват под формата на два оптични изомера.
Конфигурацията на стереоизомерите на глицералдехид се използва като стандарт при определяне наLиD-конфигурации на аминокиселини.
Местоположението на NH2 групите в проекционната формула на Фишер отляво съответства наL-конфигурацията, а отдясно наD-конфигурацията.
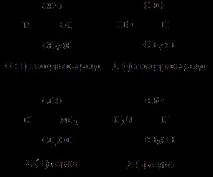
Трябва да се отбележи, че буквитеLиDозначават, че това или онова вещество принадлежи към сериятаLилиDв своята стереохимична конфигурация, независимо от посоката на въртене.
В допълнение към 20-те стандартни аминокиселини, открити в почти всички протеини, има и нестандартни аминокиселини, които са компоненти само на някои видове протеини - тези аминокиселини се наричат същомодифицирани (хидроксипролин и хидроксилизин).
Получатели
Аминокиселините са изключително важни от физиологична гледна точка. Протеините и полипептидите са изградени от аминокиселинни остатъци.
По време на хидролизата на протеинови вещества на животински и растителни организми се образуват аминокиселини.
Синтетични методи за получаване на аминокиселини:
–Действие на амоняк върху халогенирани киселини
– α-аминокиселините се получаватчрез действието на амоняка върху оксинитрилите
