Линеен спектър на водороден атом
Спектърът е набор (непрекъснати, дискретни) от монохроматични вибрации, излъчвани или погълнати от всяко тяло.
Всички светещи газове дават линейни емисионни спектри. Изследвайки линейните спектри на водородния атом,Балмърполучава формулата , (22)
където m и n са квантови числа; n е честотата на излъчения (погълнат) квант;
R \u003d 3,29 × 10 15 s - 1 - константа на Ридберг.
Ридберг показа, че в линейните спектри не само на водородния атом, но и на атомите на други елементи се наблюдават спектрални серии. По-специално, за водорода, спектралните серии могат да бъдат разграничени от набора от серии (фиг. 11):
I. серияLyman(ултравиолетов спектър), където n = 1, m = 2, 3, 4, . .
II. серияBalmer(видим спектър), където n =2,
III. серияPaschen(инфрачервен спектър), където n=3,
В спектъра на поглъщане на водорода се наблюдава само серията на Лайман, тъй като тя съответства на квантови преходи на атом от основно състояние към други възбудени състояния. Спектралните честоти на водородоподобните йони могат да бъдат намерени по формулата където ; Z е поредният номер в периодичната система от елементи на Д. И. Менделеев.Спектралните серии на водородоподобните йони са изместени спрямо спектралните серии на водородния атом. Когато атомите се комбинират в молекули и кристали, външните обвивки на атомите са силно изкривени, така че оптичните и инфрачервените спектри на молекулите са на ивици, докато тези на металите са непрекъснати.
Атомът може също да бъде възбуден чрез отстраняване на един от електроните от вътрешната запълнена обвивка. Електронът с дълбока обвивка се влияе главно от кулоновото привличане на ядрото, което е само леко екранирано от други електрони. Това скриниране се взема предвид чрез заместване на ядрения заряд с (Z - s)e, където s е коригиращият фактор (s
Постулатите на Бор
За да обясни стабилността на атомите, техните линейни спектри и други свойства на атомите, Бор предложи използването на следните постулати:
1). Съществува стационарно състояние на атома, при което той не излъчва енергия.
2). В стационарно състояние на атом, електрон,, движещ се по кръгова орбита, трябва да има квантована стойност на ъгловия импулс, т.е.
Ln= mvr = n, (23)
където m е масата на електрона; v - неговата скорост; r е радиусът на орбитата; h е константата на Планк.
Както е показала квантовата теория, n = 1, 2, 3, . , -главно квантово число, характеризира енергийните нива на атомите.
3). Когато електрон в атом преминава от по-високо възбудено енергийно нивоWmкъм по-ниско нивоWnсе излъчва енергиен квант
Когато енергиен квантe = hnmnсе поглъща от атом, един електрон преминава от енергийно нивоWn къменергийно нивоWm. Ниво n = 1 - основното, невъзбудено ниво; нива n = 2, 3, 4, . , - възбудени нива.
Първият потенциал на възбуждане на атома.
Общата енергия на електрон в атом
, (2.4)
където m е масата на електрона; e0 е електрическата константа.
Абсолютната стойност на Wn във формула (24) се наричаенергия на свързванена електрон в атом в състояние n.
Следователно нивото съответства на йонизационната енергия на водородния атом, т.е. на отделянето на електрона. Йонизационната енергия на атома е свързана с йонизационния потенциал j, т.е. Wion \u003d ej. (25)
Честотата n на излъчения (погълнат) квант се намира по формула (22).
За водороден атом при n = 1йонизационен потенциалj = 13,53 V,
W1 = = -2,16×10 - 18 J = - 13,53 eV.
Радиуси на орбитите на Бор на електрон във водородоподобни атомиможе да се изчисли с помощта на формулата
където e0 е електрическата константа; h е константата на Планк; n е основното квантово число; Z е поредният номер в периодичната система от елементи на Д. И. Менделеев; m е масата на електрона; e е елементарният заряд.
Първият боров радиус на електрона, който характеризира средния размер на водороден атом r1 @5,29×10 - 11 м. Размерът на атома се определя от неговата електронна обвивка. Скоростта на един електрон в орбитата на Бор се изчислява по формулата. За водородния атом скоростта на електрона в 1-вата орбита на Бор е v1 = 2,2×10 6 m/s (n = 1).
Опитът на Франк и Херц
Хипотезата на Бор за съществуването на стационарни състояния на атомите (1-ви постулат) и правилото за честотата (3-ти постулат) бяха потвърдени от експериментитеФранк и Херц(фиг. 12). Катодът K, който излъчва електрони поради термоелектронна емисия, мрежестият електрод S и анодът A са свързани към галванометър и поставени в стъклен съд, напълнен с живачни пари при налягане P = 0,1¸1 mm Hg. Изкуство. Между катода и решетката се създава потенциална разлика, която ускорява електроните, а между решетката и анода се създава слабо електрическо поле, което забавя електроните. Когато електрон се сблъска с живачни атоми, са възможни два вида взаимодействие:
1)еластично взаимодействие, в резултат на което енергията на електроните не се променя, променя се само посоката на движение.
Когато електроните достигнат анода, във веригата се появява електрически ток, който се увеличава с увеличаване на ускоряващата потенциална разлика;
2)нееластично взаимодействиена електрони с живачни атоми.
В този случай енергията на електроните намалява поради прехвърлянето й към атомите на живак.
В съответствие с постулатите на Бор, атомът на живака може да абсорбира енергия под формата на част от e = hn и да премине във възбудено състояние,заемащи по-високо енергийно ниво.
Първото възбудено състояние на атома на живака съответства на енергия от 4,86 eV. При енергии, по-малки от еj = 4,86 eV, електроните изпитват еластично взаимодействие с живачните атоми и анодният ток се увеличава. Когато електроните достигнат енергия Wk = 4,86 eV, възникват техните нееластични взаимодействия с живачни атоми, които получават част от енергията e = hn = 4,86 eV и преминават от нормално състояние във възбудено състояние.
Такъв електрон, загубил енергия, не може да преодолее забавящия потенциал. Следователно при ej = 4,86 eV токът намалява (фиг. 2.3). Подобно явление се наблюдава при еj = 2× 4,86 eV; ej = 3×4,86 eV; ej = 4 × 4,86 eV и т.н., когато електроните могат да изпитат две,
три и т.н. нееластични сблъсъци с живачни атоми, губят енергия и не могат да достигнат анода.
В този случай се наблюдава рязка промяна на тока (фиг. 13). Атомите на живачните пари, след като са получили част от енергията от електрони, преминават във възбудено състояние и заемат енергийно ниво с по-висока енергия.
След изтичане на време t » 10 - 8 s, атомите спонтанно се връщат в първоначалното си състояние, излъчвайки квант светлина с дължина на вълната l » 254 nm (ултравиолетово лъчение), което е регистрирано по време на експеримента.
По този начин теорията на Бор се опита да свърже класическите идеи за явленията, наблюдавани в експерименти, с разпоредби, които противоречат на класическата физика и изиграха значителна роля в развитието на квантовата механика.
Опитът на Стърн и Герлах
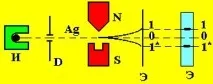
През 1922 г. Стърн и Герлах организират експеримент, при който лъч от сребърни атоми на източника А преминава през диафрагмата D и след това под формата на тесен лъч се насочва между магнитните полюси N и S на силно нехомогенно магнитно поле (по оста Z) ие регистрирано на екран E (фиг. 14).
Опитът показва, че атомният лъч на среброто на екрана E се разделя на два компонента 1 и 1 * , вместо на един (0), както би трябвало да бъде според класическата теория.
Беше направено заключението, че сребърните атоми имат магнитен момент, чиято проекция върху посоката на магнитното поле (ос Z) приема две дискретни стойности, т.е. квантувани.
По-късно беше показано, че това се дължи на наличието на магнитен спинов момент на електрона, който приема две стойности: ms = ±1/2.