МОДЕЛ НА ТРАНСФЕР НА ЗАРЯД – ЕЛЕКТРОПРОВОДИМОСТ НА РАЗТВОРИ НА ХЛОРОВОДОРОД В
Съществуващите теории за електролитни разтвори не дават пълна картина на състоянието на молекулите и йоните в произволен разтворител. Изследователите са изправени пред големи трудности при намирането на такива ключови характеристики на йоните в разтвора като числото на солватация, радиуса на солватирания йон и енергията на междумолекулните взаимодействия.
По-рано [1–3] беше предложена плазменоподобна теория на електролитите, която описва йоногенен разтвор като система от заряди, осцилиращи с плазмена честота, която зависи както от свойствата на самия електролит, така и от макроскопичните параметри на средата. Авторите са показали, че тази теория задоволително описва дисипативните свойства на водни разтвори на неорганични соли.
Целта на тази работа беше да се тества валидността на подобната на плазма теория за електролити в неводни разтворители, които бяха избрани като четири n-алкохола (етанол, пропанол, бутанол и пентанол). Солната киселина беше избрана като електролит и еквивалентната електрическа проводимост беше избрана като измерен параметър. Хлороводородът не е избран случайно, тъй като, както е известно, водородният йон има специфичен релеен механизъм на транспортиране в разтворители и в момента няма теория, която надеждно да описва неговите транспортни свойства.
Експериментално
Всички алкохоли с химическо качество бяха предварително дехидратирани съгласно стандартни процедури [4–6], накрая изсушени над молекулни сита (3Å) и съхранявани в тях под вакуум. Съдържанието на вода по Карл-Фишер [7] не надвишава 0,01%. Хлороводородът се получава чрез взаимодействие на калиев хлорид (химически чист) с концентрирана сярна киселина (химически чиста), изсушава се чрез преминаване през две колби с киселина и преминава под вакуум през колба с алкохол. Разтворите се приготвят по методасерийни разреждания по тегло, началните концентрации се установяват чрез четирикратно титруване с 0,1 М воден разтвор на калиев хидроксид (чистота за реактив) при атмосферно налягане.
Устройството за измерване на електропроводимостта на електролитни разтвори се състои от три основни елемента: измервателна част, кондуктометрична клетка и термостат [8].
За измервания беше използвана вакуумна клетка Pyrex с три плоскопаралелни кръгли платинени електрода, покрити с платинено черно. Съпротивлението на разтвора се измерва при честота от 1000 Hz. За поддържане на температурата в термостата е използвана схема, използваща високоточен температурен регулатор VRT-3 [9]. Точността на поддържане на температурата е ±0,01 K. Константата на клетката се определя чрез измерване на съпротивлението на водни разтвори на KCl в изследвания диапазон на концентрация. Получените стойности на еквивалентната електрическа проводимост са дадени в табл. 1.
Таблица 1.
Експериментални данни за еквивалентната електропроводимост на хлороводорода в n-алкохоли при различни температури (λ [S cm 2 mol -1], C [mol / l]).
Грешката при определяне на константата на клетката не надвишава 0,25%, общата грешка при определяне на еквивалентната електрическа проводимост не надвишава 1,4%.
Изчисляването на еквивалентната електрическа проводимост се извършва съгласно уравнението на плазмено-хидродинамичната теория на електролитите [10]:
(1)
където F е константата на Фарадей, z е ефективният заряд, e е елементарният заряд, ε е диелектричната константа на средата, R е универсалната газова константа, T е температурата в К, ħ е константата на Планк, C е еквивалентната концентрация на електролита, mol/l, NA е константата на Авогадро, kB е константата на Болцман, U е енергията на водородната връзка на разтворителя, μ0 -намалена маса на несолватирани йони, μs - намалена маса на солватирани йони (катион и анион), α - степен на електролитна дисоциация, rD - радиус на екраниране на Дебай, равен на [10]:
(2)
rs е намаленият радиус на солватирани йони [11,12]
(3)
където ns е числото на солватация, равно на [13-16]:
(4)
Избрахме следния израз като степен на електролитна дисоциация:
(5)
Основните трудности при изчисляването на електрическата проводимост възникнаха поради два фактора:
1. Водородният йон, за разлика от металните йони, в протогенните разтворители, дори теоретично, не може да бъде представен в отделно състояние поради малкия си размер, следователно не е възможно да се изчисли стойността на μ0 (намалена маса на несолватирани електролитни йони) въз основа на масата на протона, равна на единица. Необходимо е да се направят определени предположения за масата и радиуса на водородния йон въз основа на познаването на неговата солватация в съответните системи.
2. Енергията на междумолекулното взаимодействие на молекулите на разтворителя е неизвестна за по-голямата част от разтворителите. За алкохолите се състои от енергиите на специфично (водородна връзка) и неспецифично (хидрофобно) взаимодействие.
Ще анализираме тези проблеми отделно.
По този начин, в рамките на плазмоподобната теория на електролитите, може да се приеме, че минималното солватно състояние на протона съответства на състоянието с ns = 2. Както ще се види по-долу, това предположение е напълно оправдано при по-ниски алкохоли.
където Rs е радиусът на молекулата на разтворителя, r (H + ) = 0,26Å [19]. Това приблизително съответства на структурата на симетрична водородна връзка между протон и две молекули на разтворителя.
Таблица 2.
Настроикисолватация на HCl в n-алкохоли
Ако в (1) заместим стойността C = 0, тогава получаваме израз за изчисляване на енергията на междумолекулно взаимодействие.
(6)
По този начин става възможно да се изчисли енергията на междумолекулно взаимодействие при всяка температура (Таблица 2).
Изчисляване на еквивалентна електропроводимост. Въз основа на установените параметри на солватация на хлороводород, стойностите на неговата еквивалентна електрическа проводимост са изчислени в съответствие с уравнение (1). Като критерий за съответствие между теория и експеримент е избрано отношението λexp/λtheor, където теоретичните стойности са стойностите, получени от уравнение (1), а експерименталните са данните, получени от нас. На фиг. Фигура 1 показва графиките на отношението λexp/λtheor в целия диапазон от концентрации за четирите изследвани алкохола в изследвания температурен диапазон.
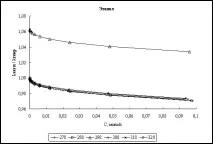
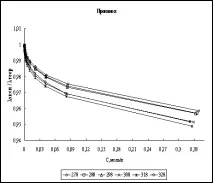

Фиг. 1. Концентрационна зависимост на отношението λexp/λtheor в различни алкохоли при различни температури
Както се вижда от графиката, само за етилов алкохол съотношението на изчислените и литературните стойности надвишава единица. Това се обяснява с факта, че за етанол при 298K е взета литературната стойност на енергията на междумолекулното взаимодействие (27,96 kJ/mol), а за всички останали алкохоли енергийната стойност е получена от ур. (3) от познаването на граничната електрическа проводимост на HCl в тези алкохоли. Очевидно в този случай отношението λexp/λtheor при безкрайно разреждане (C = 0) ще бъде точно равно на единица (виж уравнение 3).
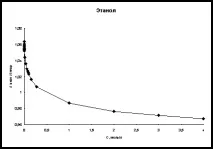
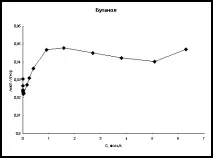
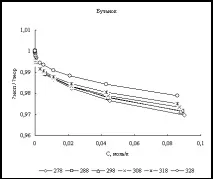
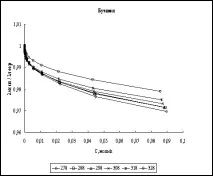
Фиг. 2. Концентрационна зависимост на отношението λexp/λtheor в етанол и бутанол при високи концентрации на хлороводород (T=298K)
Също така, за пълнота,бяха извършени изчисления на еквивалентната електрическа проводимост в областта на високи киселинни концентрации. Данните от [21] са избрани като литературни данни. На фиг. Фигура 2 показва графики на зависимостта на концентрацията на λexp/λtheor при 298K за етанол и бутанол.
Анализирайки фиг. 1 и 2 можем да кажем, че несъответствието между експерименталните и изчислените стойности, дори при високи концентрации, е около няколко процента във всички алкохоли. Това предполага, че при направените предположения плазмената теория на електролитите описва добре електрическата проводимост на хлороводорода в тези четири n-алкохола.