Обща характеристика на реактивността на пиролите, тиофените и - фураните
Начало / — Следващи глави / Общи характеристики на реактивността на пиролите, тиофените и фураните
12. Обща характеристика на реакционната способност на пиролите, тиофените и фураните
В тази глава се разглеждат общите принципи на реактивността на петчленните хетероциклични съединения - пироли, тиофени и фурани, а също така се предоставя сравнителен анализ на реактивността на представители на този клас хетероциклични съединения.
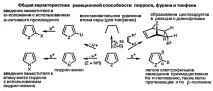
Основата на химията на пирол, тиофен и фуран се определя от способността на тези съединения лесно да влизат в реакции на електрофилно заместване, главно в α-позиция. Електрофилното заместване в β-позиция протича по-лесно и обикновено, ако α-позициите са заети от заместители. В началния етап на изучаване на химията на хетероцикличните съединения трябва да се обърне специално внимание на значителната разлика в реактивността на пет- и шестчленните хетероциклични съединения: първите реагират с електрофили по-лесно от бензола, докато вторите са много по-трудни.
Региоселективността в реакциите на петчленни хетероциклични съединения с електрофили, както и високата реактивност на хетероцикличните съединения от този клас в такива реакции, могат да бъдат обяснени чрез разглеждане на междинни съединения на Wieland (свързани с преходни състояния, водещи до тяхното образуване). Прикрепването на електрофилен вид както в α-, така и в β-позиция води до образуването на стабилизирани катиони (показани на диаграмата за пирол).
Делокализацията на положителния заряд с участието на електроните на хетероатома се проявява в по-голяма степен в междинните продукти, образувани по време на атаката на електрофила в α-позиция, което е яснодемонстриран от голям брой нискоенергийни резонансни форми. Трябва също да се отбележи, че в междинните съединения, образувани при атака на електрофила в β-позиция, резонансната стабилизация с участието на двойната връзка въглерод-въглерод е невъзможна.
Когато се сравняват реакциите с пиролови и анилинови електрофили, е лесно да се открие сходството на тяхната реактивност
Петчленните хетероциклични съединения не реагират с електрофили при хетероатома. За начинаещ в изучаването на химията на хетероцикличните съединения този факт може да изглежда изненадващ. Наистина, както може да се очаква, несподелената електронна двойка на азотния атом в пирола трябва лесно да взаимодейства с електрофилите, както се случва в случая на пиролидин, напълно наситен аналог на пирола. Разликата се състои в това, че добавянето на електрофилна частица към азотния атом на пирола води до значителна загуба на резонансна стабилизация - молекулата се превръща по време на това взаимодействие в цикличен бутадиен с прикрепен азотен атом и освен това с локализиран положителен заряд.
Като се има предвид това, аналогията с анилин губи всякакъв смисъл и наистина анилините лесно реагират с прости електрофили (например протон) при азотния атом. Съществената разлика е, че въпреки че взаимодействието на електрофила с анилиновия азотен атом причинява известна загуба на стабилизация, свързана с припокриването на несподелената електронна двойка на азота с бензеноидната π-електронна система, самата бензеноидна π-система остава непроменена.
От петчленните хетероциклични съединения (пирол, фуран, тиофен) пиролът е най-податлив на реакции с електрофили, което се свързва с по-голямата електронодонорна способност на неутралния тривалентен азотен атом, както и с по-голяма стабилност.положително зареден четиривалентен азотен атом. Този факт лесно се потвърждава чрез сравняване на относителната основност на наситени амини, сулфиди и естери. Серията на основност идеално илюстрира относителната реактивност на пирол, фуран и тиофен по отношение на атаката на електрофил върху въглероден атом и способността на съответния хетероатом да стабилизира получените междинни продукти поради способността за отдаване на електрони.
Количествено по-голямата реактивност на пирола в сравнение с реактивността на фурана и тиофена може да се илюстрира чрез високата скорост на реакция на пирол с фенилдиазониевия катион и азотиста киселина; нито фуранът, нито тиофенът реагират с тези електрофили. Също така е важно да се отбележи, че N,N-диметиланилинът също реагира лесно с тези електрофилни реагенти, докато анизолът не реагира.
Заместителите, които вече присъстват в петчленния хетероцикличен пръстен, точно както в случая на заместени бензени, имат известен ориентиращ ефект. Например, алкиловите групи допринасят за атаката на електрофила в орто и пара позиции, нитро групата - в мета позиция, въпреки че, строго погледнато, тези термини не могат да се прилагат в случай на петчленни хетероциклични съединения. Тенденцията към преференциално заместване в α-позиция доминира ръководното влияние на заместителите в много случаи, а продуктите от реакцията на заместване, образуването на които се дължи на това влияние, обикновено са незначителни в сравнение с продуктите на заместване в свободната α-позиция. Насочващото влияние на заместителите се проявява най-малко при фурана.
Съществена разлика между реакциите на фуран с електрофилни реагенти е, че в този случай понякога се образуват 2,5-присъединителни продукти. Образуването на такивапродукти се инициира от първоначална електрофилна атака в α-позиция, водеща до обичайното междинно съединение на Wieland, което впоследствие, в присъствието на реактивен нуклеофил, не губи протон, а се превръща в 2,5-присъединителен продукт. Обикновено чрез избиране на определени реакционни условия може да се постигне образуването на „нормален“ продукт на α-заместване.
Тази характеристика на реакциите на фуран с електрофили е свързана с ниската енергия на резонансна стабилизация за фуран, което определя по-ниската тенденция на междинния продукт, образуван в резултат на първоначалното добавяне на електрофилна частица към фуран, за намаляване на ароматната система на фуран в резултат на загуба на протон.
Намаленият ароматен характер на фурана също се проявява в по-голяма склонност на фурана да влиза в реакциите на Diels-Alder като диен в сравнение с други петчленни хетероциклични съединения, като пирол и тиофен. Пиролът и тиофенът също могат да участват като диени в реакцията на Дилс-Алдер, но за да бъдат успешни такива реакции, е необходимо или повишено налягане, или е необходимо да се „понижи“ ароматната природа на пръстена чрез въвеждане на електрон-оттегляща група към пироловия азотен атом.
За разлика от шестчленните хетероциклични съединения с електрон-дефицит като пиридин и диазини, петчленните хетероциклични съединения не се характеризират с реакции на нуклеофилно заместване, освен в случаите (особено характерни за производните на фуран и тиофен), когато халогенният атом е разположен в орто или пара позиция по отношение на нитро групата. Различни паладий(0)-катализирани реакции на свързване се използват широко за синтезиране на различни производни на петчленните хетероциклични съединения от тази група, както е показано отпо-долу (вижте раздел 2.7. за подробно обсъждане на такива процеси).
Реакциите на депротониране са изключително важни за синтеза на различни производни на пирола, тиофена и фурана. Фуранът и тиофенът се депротонират от такива силни основи като n-бутиллитий и литиев диизопропиламид и се образува α-анион, тъй като водородният атом в тази позиция има подвижност поради индуктивния ефект на изтегляне на електрони на хетероатома. Полученият по този начин анион е способен да реагира с голямо разнообразие от електрофили, за да образува α-заместени фурани и тиофени.
Тази методология значително разширява възможността за използване на процеси на електрофилно заместване при синтеза на различни производни на фурани и тиофени, тъй като дава възможност да се получат изключително α-заместени съединения, както и да се използват дори слаби електрофилни реагенти. Използването на металирани N-заместени пироли също осигурява ценен синтетичен подход към различни α-заместени пироли. При липса на заместител при азотния атом, депротонирането на пирола води до пирилов анион, който има нуклеофилни свойства, и когато взаимодейства с електрофилни реагенти, се образуват индолови производни, заместени при азотния атом.
Възможността за взаимодействие на електрон-донорен хетероатом с положителен заряд, локализиран в страничната верига, особено в α-позицията на пръстена, осигурява редица ефекти, най-важният от които е да се увеличи реактивността на напускащата група, разположена в страничната верига.
Подобно влияние на хетероатома засяга карбонилните групи в α-позиции; горните резонансни структури обясняват до известна степен по-ниската активност на карбонилните групи в такива съединения.
Петчлененхетероцикличните съединения са много по-малко стабилни при окислителни условия от бензоидните съединения, с изключение на тиофените; Като цяло тиофените са най-близки по своите свойства до карбоароматните съединения. Хидрогенирането на тиофени, особено при използване на никелови катализатори, води до редукция и отстраняване на хетероатома. За пиролите и фураните са известни някои контролирани редукционни процеси, водещи до образуването на дихидро производни.
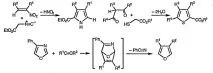
Интензивно са разработени методи за синтез на петчленни хетероциклични съединения, което е довело до създаването на голямо разнообразие, включително фини, синтетични подходи. Всеки от представителите на разглеждания клас хетероциклични съединения може да бъде получен от 1,4-дикарбонилни съединения в резултат на киселинно катализирана циклодехидратация (в случая на фуран) или реакция с амоняк, първични амини или източник на сяра (в случай на пирол и тиофен, съответно).
Като илюстрация на разнообразието от методи за синтез на петчленни хетероциклични съединения, представяме следните три процеса: добавяне на изонитрил към α,β-ненаситено нитро съединение, последвано от елиминиране на азотиста киселина; използване на реакцията на естери на тиогликолова киселина с 1,3-дикарбонилни съединения за получаване на естери на тиофен-2-карбоксилна киселина; превръщане на изоксазол във фуран в резултат на реакция на циклоприсъединяване, последвана от циклореверсия.
12. Обща характеристика на реакционната способност на пиролите, тиофените и фураните