Радикално заместване
Отговор:
В молекулите на алкани C–H връзките са пространствено по-достъпни за атака от други видове, отколкото по-слабите C–C връзки. При определени условия връзките C–H се разкъсват и водородните атоми се заменят с други атоми или групи от атоми.
Халогенирането на алкан е реакцията на заместване на един или повече водородни атоми в молекула на алкан с халоген. Продуктите на реакцията се наричат халоалкани или халогенни производни на алкани.
Условия за радикални реакции:
- повишена температура (често реакцията се извършва в газова фаза),
- действието на светлина или радиоактивно излъчване,
- наличие на съединения - източници на свободни радикали (инициатори), неполярни разтворители.
Животът на свободните радикали е по-кратък от този на органичните йони. Например свободният метилов радикал CH3 може да съществува само 0,003 s. Но точно такива радикали са от най-голямо значение в органичната химия. С тяхно участие протичат множество реакции - халогениране, нитриране, сулфохлориране, както и изгаряне, пиролиза, експлозия, полимеризация, разрушаване и др. Тези реакции се наричат верижни (радикални). Тяхното откритие е едно от забележителните събития в химията. Огромен принос в изучаването на верижните реакции и създаването на тяхната теория направиха академик Н. Н. Семенов (1896–1986) и английският учен С. Хиншелуд. Те бяха удостоени за това с най-високото научно отличие - Нобеловата награда.
При достатъчно количество хлор реакцията продължава и води до образуването на смес от продукти на заместване от 2, 3 и 4 водородни атома:
Реакцията на халогениране на алканите протича по радикалния верижен механизъм, т.е. като верига от последователни трансформации, включващисвободни радикални частици.
Механизъм на радикално заместване (символ SR) на примера на монохлориране на метан
Етап 1 -започване на веригата- появата на свободни радикали в реакционната зона. Под действието на светлинна енергия връзката в молекулата Cl:Cl се разрушава хомолитично до два хлорни атома с несдвоени електрони (свободни радикали) Cl:
Етап 2 -растеж (развитие) на веригата. Свободните радикали, взаимодействайки с молекулите, пораждат нови радикали и развиват верига от трансформации:
(Реакцията Cl· + CH4 à CH3Cl + H· не протича, тъй като енергията на атомния водород H· е много по-висока от тази на метиловия радикал ·CH3).
Етап 3 -отворена верига. Радикалите, свързвайки се помежду си, образуват молекули и прекъсват веригата от трансформации:
Когато хлорирате или бромирате алкан с вторични или третични въглеродни атоми, най-лесният начин е да замените водорода при третичния атом, по-трудно за вторичния и още по-трудно за първичния.
Това се обяснява с по-голямата стабилност на третичните и вторичните въглеводородни радикали в сравнение с първичните поради делокализацията на несдвоения електрон. Следователно, например, когато пропанът е бромиран, основният реакционен продукт е 2-бромопропан:
Реакции на нуклеофилно заместване SN1 и SN2
Основният принос в изследването на реакциите на заместване при sp3 хибридизирания въглероден атом е направен от Ingold.
Класически пример за реакция на нуклеофилно заместване е превръщането на алкил халид в алкохол:
R–Cl + HO– → R–OH + Cl–
При изследване на кинетиката на реакции от този тип беше установено, че те могат да протичат по два механизма (мономолекулно и бимолекулно заместване), които съответстват на кинетичните зависимости:
Обозначаване на реакцията (S6N71) и(SN2) също е предложен от Ingold и означава, съответно, като нуклеофилно заместване мономолекулно и бимолекулно (от англ. Substitution nucleophilic).
Пример за реакцияSN1 - хидролиза на 2-метил-2-хлоропропан (триметилхлорометан,tert-бутил хлорид)
Обща схема на реакция:
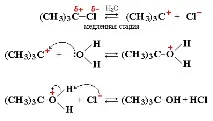
Органичните катиони и аниони са нестабилни междинни частици. За разлика от неорганичните йони, които постоянно присъстват във водни разтвори и стопилки, те се появяват само в момента на реакцията и веднага влизат в по-нататъшни трансформации.
Предполага се, че реакцията SN2 протича по следната схема:
Ако в изходното съединение съществува някаква оптична конфигурация (D–, L– ), тогава в резултат на реакцията възниква нейната инверсия (L–, D–).
Реакциите от този тип включват предимно пространствено незатруднени първични алкил халиди, които не образуват стабилизиран карбокатион, когато напускащата група се отцепи.
Условия за йонни реакции:
са полярни разтворители, способни да солватират получените йони.
Действието на светлината или радиоактивното лъчение не влияе върху скоростта на йонните реакции.
Влияние на различни фактори върху реакциите на нуклеофилно заместване при наситен въглероден атом
| Фактори | SN1 | SN2 |
| Структурата на субстрата | Реактивностпопадав серията: бензил, алил > третичен > вторичен > първичен | Реактивносттасе повишавав серията: Бензил, алил Br > Cl > F. При фиксирано X, скоростта на разцепване следва реда: третичен R>gt; вторичен R> първичен R. Пространствени препятствия имат върху реакцията E2много малък ефект в сравнение с SN2 реакциите. Разцепването в случай на третични халиди е много лесно. |
Влияние на атакуващата частица.
Обикновено са необходими сравнително силни основи за провеждане на Е2 реакции. В редица бази ефективността варира успоредно с тяхната сила: H2N - > C2H5O - > HO - > CH3COO - . Съответно, слабо алкални реагенти като йодидни или ацетатни йони улесняват нуклеофилното заместване. Елиминирането също доминира заместването при повишени температури. В случай на алкил халогениди с различни алкилови остатъци, има възможност за образуване на два алкена:
Повечето реакции на разцепване тип E2 се характеризират с образуването на най-заместения алкен тип II. Въпреки това, в случай, когато напускащата група има голям обем или има силни свойства на изтегляне на електрони, а също и ако атакуващата основа има голям обем, може да е по-благоприятно да се образува най-малко стабилният (най-малко заместен) алкен -Правилото на Зайцев.