Резюме Методически разработки на урока по темата - Алкохоли - Банка с резюмета, есета, доклади,
Напишете уравнения и наименувайте веществата.
CH 3 - CHCl - CH 2 - CH 3 + KOH (воден)
CH 3 - CHCl - CH 2 - CH 3 + KOH (алкохол)
Извършете трансформации: метан - етан - етен - етанол - въглероден диоксид
Определете молекулното тегло на веществото А: етанол - А - 1,2-дихлороетан.
Каква маса натриев етоксид ще се получи при взаимодействието на етанол с тегло 11,5 g с натрий с тегло 9,2 g?
| Вариант 5 | Вариант 6 |
Защо точката на кипене на алкохолите е много по-висока от съответните въглеводороди?
Колко изомерни бутилови алкохоли могат да се образуват от изомерни C4H8 алкени по време на тяхната хидратация?
Напишете уравненията на реакциите, в резултат на които от метан може да се получи бутадиен-1,3.
Метанол с тегло 2,04 kg се получава чрез взаимодействие на въглероден оксид (11) с обем 2 m3 с водород с обем 5 m3 (nu). Намерете добива на продукта от реакцията.
Определете масата на пропанол-2, взета за реакцията, ако по време на дехидратацията на пропанол-2 е получен пропен, който обезцветява бромната вода с тегло 200 g. Масовата част на брома в бромната вода е 3,2%.
Защо е невъзможно да се получи 100% етанол от неговия воден разтвор чрез физични методи?
Колко изомерни третични алкохоли имат състав .С6Н13 ОН ? Напишете формули и име.
Напишете уравненията на реакциите, в резултат на които от метан може да се получи диетилов етер.
Каква маса бутадиен-1,3 може да се получи от алкохол с обем 230 литра и плътност 0,8 kg / l, ако масовата част на етанола в алкохола е 95%? Добивът на реакционния продукт е 60%.
Изчислете масата на екстрахирания продукт, ако добивът на двата етапа на синтеза е 60% всеки, ако е известно, че от пропанол-2 с тегло 24 g2-бромопропан, от който е синтезиран 2,3-диметилбутан.
Химични свойства на алкохолите
Едновалентните алкохоли не са нито алкални, нито киселинни. Водните разтвори на алкохоли не влияят на показателите.
Помислете за химичните свойства на алкохолите, като използвате етанол като пример. В молекулата на етанола CH3–CH2–OH има четири типа химични връзки, които се различават по полярност: 1) H–O;
2) C–O; 3) C–H; 4) S–S. В резултат на химичните трансформации най-полярните връзки H–O, C–O и C–H се разрушават. Неполярната C–C връзка не се разрушава при реакциите на алкохолите.
1. Разкъсване на H–O връзката при реакция с натрий:
2. Едновременно разрушаване на връзките H–O и C–H, разположени при въглеродния атом на алкохола под действието на окислител (CuO) с елиминирането на молекулата на H2O и образуването на алдехид (CH3CHO):
Разрушаване на връзката под действието на нуклеофилни реагенти (B– йони или молекули с неравномерно разпределение на заряда в молекулата) в кисела среда.
а) Действието на HCl или HBr киселини с образуването на халоалкани:
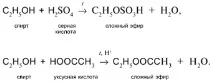
б) Действието на кислородсъдържащи киселини - неорганични и органични - с образуването на естери (за повече подробности вижте урок 29):
Модел на нуклеофилни и електрофилни процеси
4. Вътрешномолекулно елиминиране на Н и ОН от съседни С атоми в присъствието на концентрирана сярна киселина при нагряване до образуване на алкен:
5. Междумолекулно елиминиране на Н и ОН от две различни алкохолни молекули при умерено нагряване в присъствието на дехидратиращи агенти. Продуктът на реакцията е етер:
6. Алкохолите горят във въздуха с разцепването на всички връзки и образуването на въглероден диоксид и вода:
С2Н5ОН + 3О2 2СО2 + 3Н2О.
Задача. Напишете уравненията на реакцията за пропанол-1 CH3CH2CH2OH сследните реактиви: а) Na; б) CuO; c) НС1 в присъствието на H2SO4 (конц.) с нагряване; г) H2SO4 (конц.) при 160°С (алкенов продукт); д) H2SO4 (конц.) при 140°С (етерен продукт).
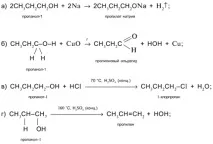
1. Напишете уравненията на реакцията на пропанол-2 CH3CH(OH)CH3 със следните реагенти:
а) Na; б) CuO; c) НС1 в присъствието на H2SO4 (конц.) с нагряване; г) H2SO4 (конц.) при 160°С (алкенов продукт); д) H2SO4 (конц.) при 140°С (етерен продукт).
2. Алуминият реагира с алкохоли като натрия. В този случай хидроксилният водород се заменя с метал и се освобождава свободен водород Н2. Реакцията протича при нагряване близо до точката на кипене на алкохола. Направете уравнения за реакциите на металния алуминий с алкохоли: а) метанол; б) етанол.
3. Защо точките на кипене на алкохолите са по-високи от тези на съответните по молекулно тегло въглеводороди (С2Н5ОН, Мr = 46, tкип. = 78 °С; С3Н8, Мr = 44, tкип. = –42 °С)?
4. Напишете реакционна схема, чрез която пропанол-1 може да се превърне в пропанол-2.
Много други класове съединения се получават от ROH алкохоли: алкилхалогениди RHal, алкени R'CH=CH2, етери ROR', естери R'COOR, алдехиди R'CHO, карбоксилни киселини R'COOH и др. Алкохолите се използват като разтворители при синтеза на нови съединения, в производството на лакове и бои, фармацевтични продукти, аромати, парфюми и козметика. Етанолът се използва като дезинфектант и гориво в двигателите. Отива и за производството на алкохолни напитки.
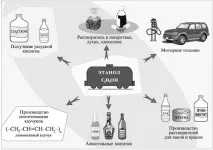
Употреба на етилов алкохол
За стабилно усвояване на знанията по химия трябва да се овладее способността да се съставят и решават вериги от химични трансформации. Решаването на верига означава да напишете уравненията на реакцията,съответстващи на всяка стрелка от схемата. В резултат на това е възможно да се получат нови необходими вещества от наличните вещества. За да разрешите вериги, трябва да знаете:
а) методи за получаване на вещества и б) химични свойства на вещества от различни класове.

Пример за верига от химически трансформации при производството на етанол
Проблем.Напишете уравненията на реакциите за веригата от трансформации:
Ще използваме удобен метод за определяне на реагентите, необходими за превръщането на едно вещество в друго: ще намерим разликата в състава на две вещества, стоящи от противоположните страни на стрелката, и ще извадим формулата с по-малък брой атоми от химическата формула с голям брой атоми. И така, за първата стрелка на схемата:
Следователно, за да се превърне алкохолът CH3CH2OH в алкена CH2=CH2, е необходимо да се отдели водна молекула от алкохолна молекула:
Втората реакция на схемата се състои в добавяне на водород към алкена:
Третата стрелка на схемата представлява реакцията на заместване на водород в алкана CH3–CH3 с хлор. Това се постига чрез действието на молекулярния хлор върху алкана:
Четвъртата трансформация е заместването на хлорния атом в хлороетан С2Н5Сl с OH хидроксилната група:
Петата реакция се състои в елиминирането на два водородни атома от молекулата на алкохола. На практика това означава окисление на алкохола с кислород [O] на окислителя, т.е. свързване на излишните Н атоми под формата на Н2О:
О.В. Байдалин. За приложния аспект на химическите знания // Химия в училище, 2005, № 5, с. 45-47.
Ахметов Н.С. Методи за преподаване на темата "Закономерности на хода на химичните реакции" // Химия в училище. 2002, № 3, стр. 15 - 18.
Ахметов Н.С. Учебник за 8 клас учебни заведения. М.: Просвещение, 1998
Рудзитис Г.Е., Фелдман Р.Г. Учебник за 8 классредно училище. М.: Просвещение, 1992.
ОПЕРАЦИОННА СИСТЕМА. Габриелян, Н.П. Воскобойников, А. В. Ящукова. Наръчник на учителя. Химия. 8 клас. М.: Дропла, 2003
Малинин К.М. Технология на сярната киселина и сярата. М., Л., 1994.
Василиев Б.Г., Отвагина М.И. Технология на сярната киселина. М., 1985.
Отвагина М.И., Явор В.И., Сретенская Н.С., Шарифов М.Ю. Индустрия на минерални торове и сярна киселина. М., НИИТЕХИМ. 1972 г. Брой № 4.
Резницки И.Г. Възможности за използване на азотния метод за преработка на газове от автогенни процеси в сярна киселина / Цветни метали. 1991. № 4.
Березина Л.Т., Борисова С.И. Използването на фосфогипс - най-важният екологичен проблем // Химическата промишленост. 1999 г. № 12.
Громов А.П. Екологични аспекти на производството на сярна киселина // Екология и индустрия на България. 2001, № 12.
Лидин Р.А. Химия: Ръководство за изпити / Р. А. Лидин, В. Б. Маргулис. - M .: LLC Издателство "AST": LLC "Издателство Astrel", 2003. p. 64-70.
Единен държавен изпит 2002: Контролни измервателни материали: Химия / A.A. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М .: Просвещение, 2002. - с. 39-51.
Химия: Голям справочник за ученици и постъпващи в университети / E.A. Алферова, Н.С. Ахметов, Н.В. Богомолова и др., М.: Дрофа, 1999. с. 430-438
Р.П. Суровцева, С.В. Сафронов. Задачи за самостоятелна работа по химия. М.: Просвещение, 1993