Схема на основните етапи в развитието на инфекциозно-токсичен шок
Аз. СПЕШНА ПОМОЩ В КЛИНИКАТА ПО ИНФЕКЦИОННИ БОЛЕСТИ
ИНФЕКЦИОННО-ТОКСИЧЕН ШОК
Последните 20-25 години е периодът на развитие на концепцията за единно патофизиологично развитие на всички видове шок.
Понастоящем терминътшок означава синдром на полиорганна недостатъчност, който се развива в резултат на нарушена кръвна перфузия на органи и тъкани. Намаляването на перфузията може да бъде свързано със сърдечната дейност или намаляването на венозния кръвен поток поради несъответствие между обема на кръвоносното легло и обема на циркулиращата кръв.
В последния случай причината за шока може да бъде:
А) загуба на кръв или плазма - хиповолемичен хеморагичен шок.
Б) загуба на течности и електролити - дехидратационен хиповолемичен шок.
В) отлагане на кръв в микроваскуларното русло - инфекциозно-токсичен шок (ИТШ), анафилактичен шок.
Шок, свързан с дейността на сърцето - кардиогенен шок - възниква поради сърдечна недостатъчност при инфаркт на миокарда, тежък миокардит или механични пречки за работата му - перикардит, пневмоторакс, масивна белодробна емболия, стеноза на митрална или аортна клапа.
В практиката на лекар по инфекциозни заболявания може да се срещне всеки от тези варианти на шок, но все пак основната причина за спешни състояния и смъртни случаи от болестта е инфекциозно-токсичният шок.
На практика TSS може да възникне при всеки инфекциозен процес, протичащ с тежка интоксикация, но най-често се среща при грам-отрицателни инфекции, придружени от генерализиране на патогена - сепсис, причинен от грам-отрицателна флора, особено менингококова септицемия, коремен тиф, дизентерия, салмонелоза, чума, генерализирани форми на йерсиниоза. Притози причинен фактор се счита за ендотоксин на грам-отрицателни бактерии (липополизахариден комплекс - LPS). В същото време типична клиника на TSS може да възникне и при грам-положителни инфекции, рикетсиоза, хламидийна инфекция, вирусни заболявания, кандидозен сепсис и дори такива инвазии като трихинелоза.
Патогенеза на TSS
Що се отнася до патогенезата на TSS, не може да се каже, че е задълбочено проучена. Има достатъчно бели петна, които пораждат противоречиви подходи към различните аспекти на терапията му и доста висока смъртност.
Най-честата и надеждна връзка между развитието на ендогенна интоксикация и по-специално TSS е свързана с действието на ендотоксина на грам-отрицателна бактерия, така наречения LPS комплекс. Експерименталните и клинични наблюдения потвърждават, че когато грам-отрицателните микроорганизми се унищожават в дебелото черво, се образува голямо количество LPS, но при здрав човек стомашно-чревната лигавица е непроходима за него. В същото време експерименталните изследвания доказват, че незначителни концентрации на LPS все още влизат в системното кръвообращение (SC). Тези ниски концентрации имат положителен ефект върху нормалния метаболитен и особено имунен отговор на макроорганизма. Такива незначителни концентрации на LPS в SC на здрав човек се дължат на наличието на антиендотоксинова защитна система, която включва антиендотоксин, така наречените Re-антитела, липопротеини с висока плътност, протеини от острата фаза на възпалението, гликопротеини, левкоцити и макрофаги, които свързват и неутрализират LPS.
Въпреки това, тази система не може да се справи с масивния приток на LPS в SC при грам-отрицателен сепсис или от огнища на бързо възпроизвеждане на грам-отрицателни бактерии ввъзпалителни огнища при менингококова инфекция, коремен тиф, салмонелоза, йерсиниоза или в нарушение на пропускливостта на стомашно-чревния тракт за грам-отрицателни микроорганизми, така наречената бактериална транслокация. Във всички тези случаи необичайно високи концентрации на LPS циркулират в SC и се развива системна ендотоксемия. В резултат на това LPS започва да взаимодейства с мембраните на голям брой целеви клетки, предимно моноцити, полиморфонуклеарни неутрофили, макрофаги, тромбоцити и съдови ендотелни клетки, т.е. с клетки, които имат CD-14 рецептор.
Всеки LPS се състои от полизахарид, който е свързан със специфичното действие на този ендотоксин, и липозахарид А, който е идентичен за всички LPS и чрез който LPS се фиксира върху целевите клетки, когато взаимодейства с DM 14 рецепторите.
В резултат на това взаимодействие таргетните клетки започват да произвеждат биологично активни вещества (БАВ), така наречените цитокини. Известно е, че цитокините са основни предаватели на междуклетъчни взаимодействия, които осигуряват оптимална метаболитна хомеостаза, което ни позволява да ги разглеждаме като „микроендокринна регулаторна система“ за функционирането на клетките. Образувани в клетка, те изпълняват регулаторна и защитна функция на тази клетка (автокринно действие) или съседни клетки (паракринно действие).
Когато големи концентрации на LPS навлизат в SC, в него се образува огромно количество различни цитокини, които, циркулирайки в кръвта, имат ефект извън образуването им (ендокринен ефект). Свръхпроизводството на цитокини се нарича "цитокинова каскада" или "цитокинен хаос", което причинява "метаболитна анархия", която предизвиква шокова реакция на тялото. Автор на монографията „Шок
клетка" Шутеу (1981)образно сравнява функционирането на организма в условията на "цитокинен хаос" с поведението на човек, изпаднал в извънредна ситуация, когато не знае какво да прави и в бързината допуска неадекватни реакции.
Наистина, няколко десетки цитокини участват в цитокиновата каскада, главно с провъзпалителна природа, свързана със системния възпалителен отговор (SIRS). Това са така наречените цитокини от първа вълна - TNFα, Il-1, Il-6, тромбоцит-активиращ фактор (PAF), хистамин, комплементни фрагменти C-3a, C-5a, метаболити на арахидоновата киселина - простагландини, простоциклини, левкотриени, тромбоксани А1. Голямо значение в развитието на началния стадий на шока напоследък се дава на активирането на ензима конститутивна NO-синтетаза под действието на LPS, което води до освобождаване на азотен оксид (NO) от макрофагите и ендотелните клетки, цитокин с мощен вазодилатативен ефект. В същото време противовъзпалителните цитокини IL-8 и IL-10 също влизат в SC, така че трябва да говорим за общите произтичащи ефекти.
Като се има предвид, че BAS на системата SIRS преобладават в цитокините от първата вълна, такива ефекти трябва да включватвазодилатация на микроваскуларното легло, главно венули (ΝO, хистамин, TNFα, простоциклини, простагландини Е), както иповишена съдова пропускливост (TNFα, PAF, левкотриени, C-5a). В резултат на това се развива относителна хиповолемия и склонност към понижаване на кръвното налягане (инфекциозна хипотония). Клиницистите наричат този етап "предшоков" или компенсиран шок или топъл шок. В отговор на това тялото включва компенсаторна реакция - напрежението на симпатико-надбъбречната система с освобождаването на катехоламини в кръвта. Под действието на катехоламините в мускулите, кожата, органите на стомашно-чревния тракт, бъбреците, богати на α-адренергични рецепториима спазъм на прекапилярите с отваряне на артерио-венозни шънтове, т.е. развива се централизация на кръвообращението. В централната нервна система, сърцето, белите дробове, черния дроб, където преобладават ß-адренергичните рецептори, напротив, съдовете не се свиват, броят на сърдечните удари се увеличава. Недостатъчното кръвообращение на бъбреците активира преренин-ангиотензивната система с образуването на мощен вазоконстриктор - ангиотензин-2. В крайна сметка централизацията на кръвообращението прогресира с пълно изключване на микроваскулатурата в периферията, което клинично съответства на субкомпенсирана или
студен шок. В органи и тъкани, които не получават наситена с кислород кръв, хипоксията бързо се увеличава, като аеробната гликолиза се заменя с анаеробна, с натрупването на производни на млечна и пирогроздена киселина, които не се екскретират по време на задух. При условия на нарастваща метаболитна ацидоза се активира индуцируема ΝO синтетаза, под действието на която се образува ΝO в гладкомускулните влакна на кръвоносните съдове и макрофагите, концентрацията на които в SC се увеличава стотици хиляди пъти (S.Kh. Snyder, 1992). Излишният NO блокира васкуларните норепинефринови рецептори, което ги прави нечувствителни към вазопресорното действие на катехоламините.
Схема на основните етапи в развитието на инфекциозно-токсичен шок
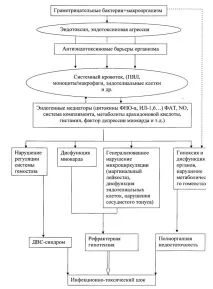
Успоредно с това, продължаващото активиране на калекреин-кининовата система с освобождаването на силно активно вазодилататорно вещество - брадикинин, води до пълно отпускане на прекапилярите на микроваскуларното легло.
Кръвта, според фигуративния израз на Теодореску-Екзарчу (1972), "се излива в собствените си съдове". Паралитично разширеното микроваскуларно легло обхваща целия BCC. Връщането на венозна кръв към сърцето рязко спада.
Нарушаването на микроциркулацията се влошава от друг ефект на цитокиновата каскада (TNFα,ФАТ, простагландини, тромбоксан А2) -повишена коагулация с образуване на кръвни съсиреци и утайки в микросъдове, както и абсолютна хиповолемия, тъй като плазмата напуска съдовото легло по осмотичния градиент. Намаляването на венозното връщане към сърцето и съответно на сърдечния дебит причинява окончателно нарушение на кръвообращението с развитие на необратими промени, т.е. синдром на полиорганна недостатъчност, декомпенсиран шок и смърт.
Възниква естествен въпрос - какъв е механизмът за развитие на клиниката на TSS при инфекции, причинени от неграм-отрицателни патогени. В медицинската литература има два отговора на този въпрос. Първият е, че ендотоксините и дори екзотоксините могат да причинят подобни на LPS ефекти. Всъщност при стафилококов сепсис в кръвта циркулира екзотоксин TSST-токсин от синдром на токсичен шок, при стрептококова генерализирана инфекция - пирогенен екзотоксин A-SpeA, при унищожаване на вируси, рикетсии, хламидия, различни ендотоксични вещества също се освобождават.
Друга гледна точка обяснява клиничната картина на TSS при инфекции, причинени от неграм-отрицателни микроби, чрез развитието на масивна транслокация на грам-отрицателни микроби от червата в кръвния поток с тежка интоксикация с развитието на системна LPS ендотоксемия с паралелно потискане на антиендотоксиновата защитна система на организма. В полза на тази хипотеза е откритието в експеримент с животни на повишени концентрации на LPS в SC по време на хеморагичен и травматичен шок.