Термодинамични цикли
Термодинамичен цикълиликръгов процессе нарича про-
процес, при който работната течност след поредица от последователни промени се връща в първоначалното си състояние. В работните и топлинните диаграми такъв цикъл е изобразен със затворена линия (фиг. 2.5). Кръговите процеси са в основата на работата на топлинни двигатели и хладилни инсталации от всякакъв вид.
Помислете за кръговия процес, изобразен на работната диаграма. Работата по секцията от цикълаABCе положителна (обемът на тялото се увеличава) и
в областтаСDA- отрицателна (обемът на тялото намалява). Но тяхната разлика е положителна, следователно получената работа също е положителна. Тя е равна на площта на затворената линияABCDА.
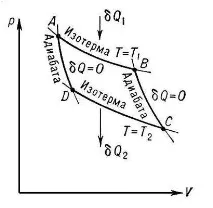
Ориз. 2.5. Директен кръгов процес на диаграматарv
Въз основа на първия закон на термодинамиката за кръгов процес можем да напишем
Тъй като в цикъла крайното състояние на работното тяло съвпада с първоначалното, т.е.u2–u1, то
къдетоlcе извършената работа в цикъла.
В разглеждания примерlc>0, следователноq1>q2. Това означава, че на топлинната диаграма линията за подаване на топлинаABSтрябва да лежи над връщащата линияCDA. В този случай линиятаABSще съответства на по-висока околна температура от линиятаCDA, т.е.T1>T2.
В резултат на цикъла част от топлината, получена от работния флуид, се предава на околната среда под формата на работа.
Кръговите процеси, при които работният флуид, получавайки топлина от източника, извършва механична работа, се наричат директниили цикли на топлинни двигатели.
Последователността на процесите в един цикъл може да бъдеи такива, когато разширението на работния флуид става при по-ниско налягане от неговото компресиране. В този случай резултатната работа ще бъде отрицателна (l2>l1).
В съответствие с първия закон на термодинамиката, топлината на цикъла също трябва да бъде отрицателна (q2>q1), което ще се случи, ако
в участъкABСсе отвежда топлина, а в участъкСDAсе подава топлина към работния флуид (фиг. 2.6). На топлинната диаграма линиятаABCще лежи над линиятаCDA, т.е.T2 >T1. Така в цикъла топлината се предава от тяло с по-ниска температура към тяло с по-висока температура.
Кръговите процеси, при които топлината се пренася от студено тяло към нагрято поради цената на работата, се наричат обратниили цикли на хладилни агрегати.
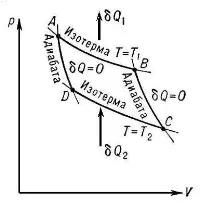
Ориз. 2.6. Обратен кръгов процес на диаграмиpvиTS
Цикъл на Карно. Изследванията на директния цикъл показват, че не цялата топлина, подадена от източника към работния флуид, може да се преобразува в работа, а само част от нея. Останалата топлина неизбежно се отклонява към източник на студ.
Съотношението на количеството топлина, преобразувано в работа за цикъл, към топлината, подадена към работния флуид, се наричатоплинен коефициент
Елемент на ефективно действиеот цикъла:
Възниква практически въпрос в кой кръгов процес (цикъл) при дадени температури на източника на топлина и приемника (хладилника) може да се получи максимална полезна работа. В термодинамиката е доказано, че такъв цикъл е кръговият процес, предложен от Сади Карно. Този цикъл се състои от две изотерми и две адиабати (фиг. 2.7).
На топлинната диаграма цикълът на Карно е представен с правоъгълник12341 (фиг. 2.7, b); ефективността на цикъла е равна на
къдетоT1 е температурата на източника на топлина, K;T2 е температурата на топлинния приемник, K.
Ефективността на цикъла на Карно зависи само от температурите на източника и приемника, при които съответно се подава и отвежда топлина към работния флуид, но не зависи от естеството на работния флуид и неговите физични свойства. Ефективността на цикъла на Карно приT1=T2 е равна на нула, което показва невъзможността за превръщане на топлината в работа, ако всички тела на околната среда имат еднаква температура. Ефективността на цикъла на Карно не може да бъде равна на единица, тъй като в природата няма източник на топлина с безкрайно висока температура или приемник на топлина с температура, равна на абсолютната нула, т.еT2 /T1> 0.
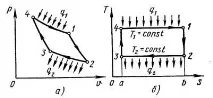
Ориз. 2.7. Цикъл на Карно върху диаграмиpv (a)иTS (b)
Изследването на термодинамичните цикли води до най-важните изводи за посоките на процесите на трансформация на работа и топлина, за неравностойността на топлината и работата.
Първият закон на термодинамиката установява количествена връзка между топлината, работата и промяната на вътрешната енергия на тялото, но не определя посоката на протичане на процесите.
Посоката на протичането на процесите, протичащи в природата, установява втория закон на термодинамиката. Според Клаузий, който дава една от първите формулировкина втория закон на термодинамиката, "топлината не може сама да премине от по-малко нагрято тяло към по-нагрято."
Трансформацията на топлината в работа е възможна само когато се прехвърля от горещ източник към студен, извършва се чрез посредничеството на работно тяло и се случва, докато има разликаобиколка на температурата между тези източници.
Превръщането на работата в топлина става без никакви ограничения, спонтанно.
Топлината може да се предава спонтанно само от по-горещо тяло към тяло с по-ниска температура, но обратното предаване на топлина от студено тяло към горещо изисква външна работа.
Тези разпоредби показват основната същност на втория закон на термодинамиката, който определя условията, при които е възможно превръщането на топлината в работа, и факторите, от които зависи ефективността на тази трансформация.
Вторият закон на термодинамиката изисква ясно разграничение между понятията обратими и необратими процеси.
Процесите се наричат обратими, ако могат да протичат както в права, така и в обратна посока, а системата по време на обратния процес последователно преминава през същите състояния, през които е преминала в права посока. Условието за осъществяване на обратими процеси е тяхното безкрайно бавно протичане, при което е невъзможно да се открие обмен на енергия между системата и околната среда, т.е. когато процесът е набор от последователни състояния, които се различават безкрайно малко от равновесието.
Необратиме процес, след който системата и взаимодействащата с нея среда не могат да се върнат в първоначалното си състояние. Всички реални процеси са необратими (неравновесни). Работа може да се извърши, ако има разлика в налягането между системата и околната среда, а топлината може да се пренесе и ако има само температурна разлика между телата. При тези процеси системата не може да бъде в състояние на равновесие, следователно те са необратими. Необратимостта на реалните явления показва еднопосочността на всички природни процеси.При всички необратими процеси се наблюдава спонтанен преход на енергия от всякакъв вид в топлинна форма, което води до увеличаване на ентропията на изолирана система.
Ентропията на всяка изолирана система, извършваща работа, никога не намалява, тя остава постоянна при обратими процеси и винаги се увеличава при необратими процеси.
Принципът на необратимостта или принципът на нарастващата ентропия е общата формулировка на втория закон на термодинамиката.
Въпроси за самоконтрол
1. Предмет на техническата термодинамика.
2. Какви са основните параметри на състоянието на термодинамичните системи?
3. Напишете и обяснете физическия смисъл на уравнението на състоянието на идеален газ.
4. Обяснете физичния смисъл на топлинния капацитет.
5. Първият закон на термодинамиката.
6. Какви термодинамични процеси познавате?
7. Вторият закон на термодинамиката.