2.5. Получаване на метален литий
Металният литий се получава по два начина - електролиза и вакуумтермия. Поради високата химична активност на лития и термодинамичната стабилност на неговите съединения, процесите на неговото получаване са свързани с редица трудности. Те се състоят в ограничения избор на производствени методи, в необходимостта да се защити полученият метал от действието на кислород, азот, въглероден диоксид и водни пари, в избора на структурни материали, които са устойчиви на действието на литий и неговите съединения и неговите съединения при повишени температури.
Електрохимично производство на литийМетален литий може да се получи само чрез електролиза на стопилка, електролизата на водни разтвори е невъзможна, тъй като във водни разтвори нормалният електроден потенциал на лития има много висока отрицателна стойност, в резултат на което на електрода ще се отдели водород (вижте таблица 1). Обикновено стопилките на халогенидите се използват за електролиза; отделните литиеви халогениди обаче са неподходящи поради високите температури на топене, при които налягането на парите на металния литий става доста високо (виж таблица 1). За да се намали температурата на топене на електролита, се използва смес от LiCl и KCl в съотношение 1: 1, този състав е близък по състав до евтектиката в системата LiCl - KCl (58,5 mol.% LiCl, T pl. = 361ºC). Електролизата се извършва при 400 - 430 ºC. Напрежението на разлагане на магнезиевите, калциевите и натриевите хлориди в стопилките е по-малко от напрежението на разлагане на литиевия хлорид при 700 ºC, V:
MgCl2 CaCl2 NaCl LiCl KCl
2,60 3,38 3,39 3,41 3,53
Тези елементи ще бъдат редуцирани на катода преди лития и следователно напълно ще преминат в метала. Напрежението на разлагане на калиевия хлорид е само малко по-голямо от напрежението на разлагане на литиевия хлорид (ΔΕ = 0,11 V). Тази малка разлика се запазва в широк диапазонтемператури, при 405 ºC напреженията на разлагане на LiCl и KCl са съответно 3,78 и 3,89 V. Освобождаването на калий на катода се увеличава, когато стопилката на електролита е изчерпана от литиев хлорид, така че съставът на електролита трябва да се коригира, като се предотврати падането на концентрацията на LiCl под 55-57%. За да се намали замърсяването на металния литий с магнезий, калций и натрий, е необходимо да се използва оригинален литиев хлорид с висока чистота.
За електролиза се използват електролизатори с разделени анодно и катодно пространство (фиг. 17).
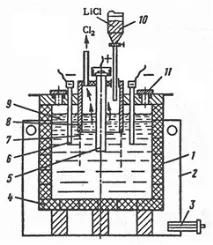
Ориз. 17. Електролизатор
Тялото на клетката е стоманено, облицовано с графит, който е устойчив на разтопен литиев хлорид. Графитната облицовка издържа около три месеца, тъй като постепенно се срутва поради образуването на литиев карбид. По-чист метал се получава в електролизери със стоманени стени с водно охлаждане, върху които се образува череп от втвърдени електролитни соли. Анодите са графитни, катодите са от мека стомана, но могат да се използват и по-устойчиви материали (ниобий, тантал). Катодното и анодното пространство са разделени от желязна мрежеста диафрагма. По време на електролиза литият, поради по-ниската си плътност от стопилката на солта (виж таблици 1 и 3), се събира на повърхността на стопилката на електролита в катодното пространство. Разтопеният литий е защитен от контакт с въздуха чрез филм от разтопени соли. Тъй като стопеният литий се натрупва, той се отстранява ръчно. Хлорът от анодното пространство се изсмуква от вентилатори и се изпраща за неутрализация с варно мляко.
Електролизата се характеризира със следните показатели: мощност на тока 90-93%, консумация на енергия за 1 kg литий до 14 kWh, екстракция на литий до 95%, напрежение на банята 6,0-6,6 V. Съдържанието на примеси в електролитниялитий, %: 0,3 - 2,5 Na; 0.02 - 1.50K; 0,02 - 0,12 Al; 0,003 Mg; 0,001 - 0,04 Ca; 0,004 - 0,85 Si; 0.01Cl.
Електрохимичният метод може да се използва за получаване на литиеви сплави с магнезий, алуминий, калций, олово и др. При получаване на сплави с нискотопими метали с ниска плътност са възможни два варианта за провеждане на процеса на електролиза. Според първия, хлоридът на съответния метал се въвежда в състава на електролита; според втория от този метал се прави катод, който при отделяне на литий се разтваря в него. Получената течна сплав се събира върху повърхността на електролитната стопилка. Електрохимичният метод е доста ефективен и се използва в индустриален мащаб.
Недостатъкът на метода е, че литиевият хлорид, необходим за електролиза, е скъп продукт, полученият метален литий е замърсен с примеси, главно натрий, освободеният хлор трябва да се неутрализира.
Вакуумно-термично производство на литий.Термодинамичният анализ на редукционните реакции на литиеви съединения се характеризира с положителни стойности на ΔG; те са особено добри за намаляване на хлориди и флуориди:
LiX + M ↔ Li + MX, където X – F, Cl, O (39)
Това се обяснява с факта, че съединенията на лития с кислорода и особено с флуора и хлора са термодинамично по-стабилни от съответните съединения на най-активните редуциращи метали (Na, Ca, Mg, Al). Само реакциите на редукция на литиев оксид с калций и магнезий имат ΔG стойност от порядъка на 10 kJ/mol, което показва тяхната обратимост. Самият литий се използва като редуциращ метал. При такива стойности на ΔG е възможно да се извърши металотермичен процес, при условие че полученият метал се отстранява от реакционната зона или получените продукти се свързват с допълнително въведен компонент. Като резултатравновесието на реакцията (37) се измества надясно, което се благоприятства от относително ниската точка на кипене на лития (1317 °C). Ниската точка на кипене на металния калций (1482 °C) и магнезия (1107 °C) изключва използването им като редуциращи агенти. Най-подходящите редуциращи агенти за литиев оксид се оказаха елементарен силиций и метален алуминий, които имат високи точки на кипене (
2500 °C съответно). Реакцията на редукция на литиев оксид със силиций се характеризира с положителни стойности на енталпията и промяна в енергията на Гибс:
ΔH = +285 kJ, ΔG = +246 kJ
Реакцията (40) е екзотермична; следователно изместването на равновесието надясно, в допълнение към отстраняването на литий, се улеснява от повишаване на температурата. Процесът на възстановяване се усложнява от появата на вторична реакция:
В ортосиликата, който е термодинамично много стабилен, 50% от лития се свързва. В сместа допълнително се въвежда калциев оксид, който образува стабилен ортосиликат Ca2SiO4. При наличие на калциев оксид в заряда, значителна част от образувания силициев оксид взаимодейства с CaO, а самият образуван литиев силикат може да бъде редуциран според реакцията:
Общата реакция на процеса се изразява с уравнението
Необходимият за процеса литиев оксид се получава чрез термично разлагане на литиев карбонат. За целта брикетирана смес от Li2CO3 и CaO в съотношение 1:1,5 се нагрява във вакуум до 850 °C. Добавя се калциев оксид, за да се предотврати топенето на Li2CO3 и да се улесни отстраняването на CO2. Получената смес от Li2O и CaO оксиди се натрошава, смесва се със силиций (10% излишък) и се нагрява във вакуумна пещ под налягане
0,1 Pa и температура 1000-1300 °C. Извличането на литий при 1000 °C е 75%, а при 1300 °C е 93%. Основните примеси са 0,01% Si и 0,04% Ca.
При редуциране на литиев оксидалуминият често свързва литий с LiAlO2 алуминат:
За да се предотврати загубата на литий, CaO се добавя към заряда, който образува Ca(AlO2)2 алуминат:
Най-добрите резултати, които правят възможно получаването на метален литий с повишена чистота, се получават чрез редуциране на литиев алуминат съгласно реакцията:
Изходният алуминат се получава чрез взаимодействие на стехиометрични количества Li2CO3 и Al2O3 във вакуум при 900-1000 °C. Процесът на възстановяване се извършва под налягане
10 Pa и температура 1150-1200 °C. Извличане на литий - 95-98%.
Металотермичната редукция на литиев оксид има предимства пред електролизата: като суровина се използва литиев карбонат, който е основният продукт на повечето технологични схеми за преработка на литиеви суровини. Методът дава възможност за получаване на по-чист литий, като редукторите са силиций и алуминий, които са сравнително евтини и достъпни.
Рафиниране на литий.Металният литий, получен по един или друг метод, съдържа примеси от алкални, алкалоземни и тежки метали, неметални примеси (кислород, азот), твърди частици. При получаване на литий с висока чистота, първо, твърдите частици се отстраняват чрез утаяване на разтопения метал под слой от парафин или трансформаторно масло или чрез филтриране през мрежести филтри, изработени от желязна, титанова или молибденова тел. Кислородът и азотът се отстраняват с помощта на блатове - прахообразен или гъбест титан и цирконий. След обработка при 800°C в продължение на 24 часа, литият съдържа следи от кислород и азот. Натрият и калият се отстраняват по метод, основан на различната стабилност на хидридите.