26.3.1.Г. Нуклеофилни пренареждания на дълги разстояния
Обикновено пренарежданията на карбокатиони са 1,2-миграция на водород (така нареченотохидридно изместване),на алкилова или арилова група. Нуклеофилните пренареждания на дълги разстояния в ациклични и моноциклични карбокатиони са редки. Въпреки това, в бициклични системи, като норборнан, 1,3-хидридната промяна е доста често срещана (вижте раздел 26.4.1.b). Алкилната група не участва в пренареждания на дълги разстояния, но може да възникне хидридно изместване на дълги разстояния. Например, в трансануларната 1,5 миграция по-горе, участва само водород, а не CH3 групата (виж уравнение 26.3). Фенилната група също е способна на миграция на дълги разстояния.
1,3-хидридното изместване вn-пропиловия катион е наблюдавано за първи път от О. А. Реутов и Т. И. Шаткина през 1960 г.
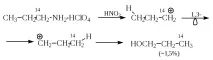
По принцип такава промяна може да се случи или като директен преход 1à3, или чрез две последователни смени 1,2.
Въпреки това, по време на последователни 1,2 преходи, остава неясно защо вторичният катион се трансформира в първичен на втория етап.
При дехидратация на 2-метил-1-бутанол (IX) се изолира 3-метил-1-бутен с добив 1,2%, който може да се образува само от катиона (X) или чрез директно 1,3-преместване, или чрез две последователни 1,2-премествания. Въпреки това, 3-метил-1-бутен не се получава от 2-метил-2-бутанол. Това означава, че (X) се образува от IX чрез директно 1,3-изместване.
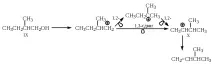
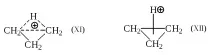
Преходното състояние на 1,3-хидридното изместване може да бъде представено от перицикъл XI, чиято структура е хомоложна на структура II.
Тъй като средната CH2 група в структура XI не участва в цикличната делокализация на електронната двойка, 1,3-хидридното отместване, както и 1,5-хидридното отместване (уравнение 26.3) валкил катиони, са по същество хомо-[1,2]-сигматропни отместваниямежду два атома, които не са пряко свързани един с друг (префиксът "хомо" означава хомология, т.е. същия вид структури II и XI, както и преходното състояние в уравнение 26.3). За да се избегне объркване, редът на отместванията на дълги разстояния е обозначен с числа без скоби и без определението „сигматропен“, а редът на сигматропната реакция с числа в квадратни скоби. По този начин, 1,8- или 1,5-хидридни премествания в алкилови или циклоалкилови катиони представляват [1,2]-сигматропна реакция (или [1,2]-сигматропно изместване).
По аналогия с представянето на преходното състояние II като "протониран етилен", преходното състояние XI може да се разглежда като "протониран циклопропан". Възможно е "протонираният циклопропан" да не е преходно състояние, а истински междинен продукт (CP).
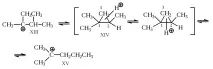
Образуването на протонирани циклопропани обяснява някои от пренарежданията в суперкиселинната среда. Например, диметилизопропилметил катион (XIII) е в равновесие с диметил-n-пропилметил катион (XV), което не може да се обясни само с 1,2-алкилови или хидридни отмествания. Реакцията се обяснява с образуването на протониран циклопропан (XIV), при който 1,2-връзката се разкъсва.
26.3.1.Г. Истинската природа на преходното състояние на нуклеофилните пренареждания и стереохимията на крайното и начално място на миграция
Истинската структура на преходното състояние при нуклеофилни пренареждания може да бъде много по-сложна, отколкото е представена от формули II или XI. При извършване на прегрупирането изходните вещества под действието на определени реагенти преминават в електронно-дефицитни частици - карбокатиони, нитрени, нитрилни йони и др. Такива прегрупирания често се случват в условията на солволиза на много органични съединения и следователнонаречена солволитична. Преходът на групата от първоначалното към крайното място на миграция може да се случи или след края на образуването на междинен продукт с дефицит на електрони, или едновременно с този процес. В резултат на миграцията могат да се образуват и нестабилни частици (например, когато един карбокатион се пренарежда в друг). Тези частици влизат в по-нататъшни реакции (добавяне, елиминиране и др.), водещи до образуването на стабилен краен продукт. Такива реакции могат да възникнат не само след пълното завършване на миграцията, но и едновременно с пренареждането.
По този начин истинското преходно състояние може да включва не само групата от атоми A, B и W, но и напускащата нуклеофужна група X - , както и входящия нуклеофил Y - (или основата, която отделя протон), което може да бъде изразено с формули XVI, XVII и XVIII.
Преходното състояние (или йонна двойка междинно съединение за W = Ar или винил) XVI е много подобно на преходното състояние на електроцикличната реакция на заместени циклопропани (вижте Схема 25.). Вероятно ароматността на тричленния пръстен в XVI или XVII е най-важният фактор, определящ скоростта на пренареждане, и следователно, както в преходно състояние II, конфигурацията на мигриращата група трябва да се запази в преходни състояния XVI или XVII (вижте раздел 26.3.1.6).
Ако началните и крайните миграционни места A и B в молекулата W-A-B-X са хирални, тогава стереохимията на пренареждането при атоми A и B ще зависи от природата на преходното състояние. В случай, когато катионът W-A-B + е достатъчно стабилен и може да съществува известно време в разтвор като независима частица, се реализира преходно състояние от тип II или тип XVIII. В резултат на пренареждането на оптически активни съединения, пълнорацемизация при атом B, тъй като по време на живота на катиона много пъти има ротация около проста връзка A-B +. Това обаче е вярно само за молекули, чиято структура не пречи на свободното въртене.
Когато свободното въртене е възпрепятствано, стереохимичният резултат ще зависи от конформацията на оригиналната молекула. Ако структурата на молекулата W-A-B-X е такава, че W и X са в синклинално положение, тогава при липса на свободно въртене ще се наблюдава конфигурацията на B. Ако W и X са антиперипланарни, тогава B трябва да има инверсия.
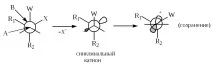
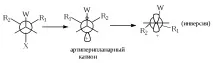
Ако катионът W-A-B + не е много стабилен, тогава не се образува "свободен" катион и елиминирането на X - става едновременно с миграцията на W. Такъв процес е по съществоSN2-реакция, в която W групата играе ролята на нуклеофил (т.е. електрони на A-W s-връзката). Стереохимичният резултат ще бъде инверсия при В (виж Формули XVI и XVII).
Разсъждавайки по абсолютно същия начин, може да се заключи, че ако след миграцията на W от A към B се образува много стабилен катион A + -B -W, реакцията ще доведе до рацемизация на хиралния център A (ако няма пречки за свободното въртене около A + -B връзката). Ако катионът A + -B-W не е много стабилен, тогава преходът на W от A към B става едновременно с атаката на катионния център, възникващ върху A, от нуклеофила Y - . В резултат на това А ще има инверсия, т.к Y - замества W от механизма типSN2 (формули ХVII и ХVIII).
Очакваната стереохимия на нуклеофилните пренареждания е обобщена в таблица 1. 26.1; резултатите от експериментални стереохимични изследвания за най-важните нуклеофилни пренареждания ще бъдат обсъдени в раздели 26.4 и 26.5.