Електростатични взаимодействия и адсорбция - Адсорбция на полимери
Адсорбцията на полиелектролити върху повърхността на твърдите вещества може да бъде разделена на три вида. Тук са показани зависимостите на повърхностния заряд и полиелектролита от pH. Общият модел е, че зарядът е положителен при ниско pH и отрицателен при високо pH. Разбира се, кривите могат също да клонят към нулев заряд или в киселинната област на рН, или в алкалната област. Фигурата показва различни области, когато полиелектролитът и повърхността носят противоположни заряди или са заредени с едно и също име.
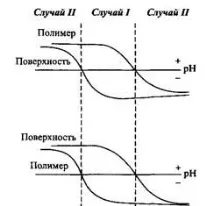
Фиг.6.Схематично представяне на промяната в заряда на полиелектролита и повърхността в зависимост от pH за два случая, когато pK на полимера е по-голямо и по-малко от pK на повърхността
В първия случай на противоположно зареден полиелектролит и повърхност, на пръв поглед изглежда очевидно, че движещата сила на адсорбцията е електростатичното привличане между полиелектролита и повърхността. Тъй като противойоните също се привличат към повърхността и към полиелектролита, тази ситуация не е толкова очевидна. Всъщност движещата сила се определя от наличието на противойони. Когато полиелектролит се адсорбира върху противоположно заредена повърхност, противойоните се освобождават както от повърхността, така и от полиелектролита и преминават в разтвор. Това води до увеличаване на ентропията на системата, в резултат на което системата преминава в състояние с по-ниска свободна енергия. Това е движещата сила на полиелектролитната адсорбция върху повърхността, носеща противоположния заряд. На тази основа може да се предвиди намаляване на адсорбцията на полиелектролита при добавяне на сол, тъй като печалбата в ентропията от освобождаването на противойони в този случай е по-малка в сравнение със системите в отсъствие на сол. Има иалтернативен възглед е, че добавената сол предпазва полимера и повърхността, намалявайки електростатичните сили на привличане между тях. Според други концепции солта, въведена в системата, се конкурира с полиелектролита за адсорбционни места на повърхността на твърдото вещество.
Във втория случай, когато полимерът и повърхността са еднакво заредени, движещата сила на адсорбцията се определя от силите на привличане на Ван дер Ваалс между полимера и повърхността.
Фиг.7.Полиелектролитна адсорбция, съответстваща на двата случая, показани на фиг.6, и ефектът на солта върху адсорбцията
Интересно е да се отбележи, че в този случай добавянето на соли води до обратен ефект в сравнение с първия случай - увеличаване на адсорбцията. Една от гледните точки относно механизма на адсорбция е, че в разтвор в отсъствие на сол локалната концентрация на противойони се увеличава по време на адсорбцията. Локалното повишаване на концентрацията на противойони е в известен смисъл "подреждане" на системата, което съответства на намаляване на ентропията и увеличаване на свободната енергия на системата. По този начин наличието на противойони предотвратява адсорбцията на полиелектролита върху повърхността с подобен заряд. Добавянето на сол намалява този ефект, което води до увеличаване на адсорбцията на полиелектролита поради изравняване на действието на противойоните. Според алтернативен механизъм въвеждането на сол предизвиква екраниране на полимера и повърхността и намаляване на силите на отблъскване между тях, както и между различните полимерни молекули, което води до увеличаване на адсорбцията на полимера.
Нека обсъдим някои поразителни примери за адсорбция на полиелектролити върху заредени повърхности. Таблица 2 показва как се променя адсорбцията на полиакрилова киселина върху каолин с въвеждането на сол. На примера на добавките на NaClМоже да се отбележи, че адсорбцията се увеличава с увеличаване на йонната сила. Това означава, че адсорбцията възниква в системата, съответстваща на случай II. Тъй като полиакриловата киселина е отрицателно заредена, може да се заключи, че адсорбцията се извършва върху една от отрицателно заредените равнини на каолиновите частици.
Таблица 2. Адсорбция на полиакрилова киселина от воден разтвор върху каолин при различни стойности на йонна сила
Въвеждането на сол на двойно зареден катион, като CaCh, води до много по-силно увеличение на адсорбцията на полиакрилова киселина в сравнение с NaCl, тъй като двойно зареденият катион има по-силна способност да скринира зарядите върху полимера и каолина, като по този начин намалява тяхното отблъскване. Както беше отбелязано по-горе, това явление може да се обясни и с увеличаване на ентропията на противойоните. С увеличаването на концентрацията на сол, печалбата от ентропия от разтварянето на полиелектролита намалява, което прави адсорбцията по-изгодна. Ефектът на ентропията е по-силен в случай на двойно заредени йони, като Ca, просто защото броят на кинетичните единици намалява. С други думи, солите на двойно заредените катиони намаляват неблагоприятните локални концентрации на йони върху полиелектролита по време на адсорбция. При наличието на тризарядни и други многозарядни йони, разтворимостта на полиелектролита намалява още повече и адсорбцията се увеличава. Има и друго мнение, което е, че въвеждането на соли доближава полиелектролитния разтвор до фазовото разделяне и следователно подобрява адсорбцията.
Началният етап на полиелектролитната адсорбция е бърз процес, но постигането на истинско равновесно състояние е много бавно, което е свързано с пренареждане и адсорбция-десорбция на компоненти с различно молекулно тегло. Измерване на повърхностна силапоказват, че този процес може да продължи няколко дни или повече.
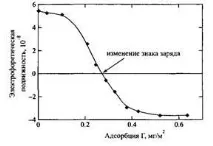
Фигура 8 показва адсорбцията на катионен полимер върху монтморилонит. Може да се види, че веднага щом повърхността стане неутрална, по-нататъшната адсорбция спира поради взаимното отблъскване на веригите. Максималната адсорбция съответства на електрически неутрална верига. Този пример показва как електростатичните взаимодействия водят до намаляване на адсорбцията, въпреки факта, че полимерът и повърхността са заредени по различен начин. Очевидно е, че адсорбцията на полиелектролита зависи и от рН на разтвора, което се определя от рН зависимостите на повърхностните или полиелектролитните заряди. Фигура 9 илюстрира тази ситуация, използвайки примера за адсорбция на протеин: когато рН се увеличава от изоточката, отрицателният заряд на протеина става по-голям като абсолютна стойност. Увеличаването на плътността на повърхностния заряд обикновено води до увеличаване на адсорбцията, тъй като системата има тенденция да стане електрически неутрална. Въпреки това, в много случаи процесът на адсорбция се контролира от неелектростатични сили, което се проявява в адсорбцията на отрицателно заредени вериги върху отрицателно заредени повърхности. Фигура 11 показва, че когато се въведе сол, адсорбцията се увеличава с увеличаване на екранирането и отблъскването между веригите намалява при високи концентрации на сол. Понякога, когато анионен полимер се адсорбира върху положително заредена повърхност, знакът на повърхностния заряд може да се промени. Такъв пример е показан на фиг. 12 за адсорбцията на поли върху полистиролови частици.
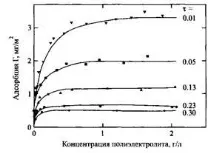
Фиг.8.Адсорбционни изотерми на катионен полимер върху отрицателно заредена повърхност на монтморилонит. Зависимостите показват как се променя адсорбцията с промяна в степента на йонизация
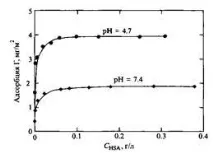
Фиг.9.Адсорбционни изотерми на серумчовешки албумин върху повърхността на отрицателно заредени частици AgI sol; концентрация на сол 10 тМ; Т= 295 К6
Когато планирате експеримент за определяне на адсорбцията на полиелектролити от физиологичен разтвор, трябва да се внимава. Съотношението повърхност/обем трябва да се контролира, тъй като солта се адсорбира съвместно с полимера. При измерване на адсорбцията в система с малка налична повърхност, коадсорбираната с полимера сол присъства в излишък. Когато провеждате експеримент в система с голяма налична повърхност, съществува риск цялата налична сол в системата да участва в коадсорбция с полимера. Тогава факторът, който определя адсорбцията на полимера, не е неговата разтворимост, а наличието на солта в дадената система. Тази ситуация е илюстрирана на фиг. 13 чрез примера на адсорбция на карбоксиметилцелулоза върху каолин от водни разтвори, съдържащи 0,0033 М CaC5 при две различни количества адсорбент в системата. При по-високо съдържание на твърдия адсорбент се наблюдава намаляване на адсорбцията на карбоксиметилцелулоза поради наличието на калциеви йони, чиято адсорбция води до намаляване на концентрацията им в разтвора.
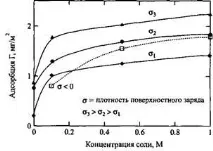
Фиг.10.Зависимост на адсорбцията на полистиренсулфонат върху положително заредени повърхности с различна плътност на заряда от концентрацията на сол в разтвора
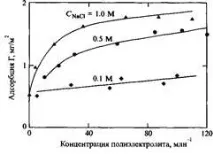
Фиг.11.Изотерми на адсорбция на полистиренсулфонат върху отрицателно заредени повърхности
Може да се заключи, че за получаване на надеждни резултати при измерване на адсорбцията на полимери е необходимо да се контролират следните параметри: молекулното тегло на полимера и разпределението по молекулни тегла в пробата, pH, йонна сила, наличие на многозарядни йони, както и малкиколичества добавки, съотношение площ към обем и температура.
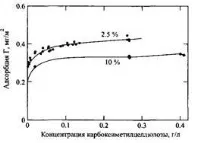
Фиг.13.Изотерми на адсорбция на карбоксиметилцелулоза върху каолин. Адсорбция от водни разтвори, съдържащи 0,0033 M CaCl2 при две различни съдържания на твърд адсорбент
За да се оцени конформацията на макромолекула на повърхността, е полезно да се използват следните критериални стойности на адсорбция. При повърхностни концентрации под 1 mg/m2, макромолекулата е плоска на повърхността; при повърхностни концентрации, близки до 3 mg/m2, полимерните молекули в монослой върху повърхността на адсорбента са в конформация на спирала. И накрая, при повърхностни концентрации над 5 mg/m 2 полимерите се адсорбират или под формата на агрегати, или с образуването на многослойни слоеве. Разбира се, дадените стойности са приблизителни, предполага се, че цялата повърхност е достъпна за адсорбция на полимера.