Хибридизацияорбитали
Помислете за образуването на молекула метан CH4. Възбуден въглероден атом има четири несдвоени електрона: един s-електрон и три p-електрона - 1 s 2 2 s 1 2 p 3.
Като се аргументира по същия начин, както в случая с H2O или N H3, може да се приеме, че въглеродният атом ще образува три C-H връзки, насочени под прав ъгъл една към друга (p-електрони), и една връзка, образувана от s-електрон, чиято посока би била произволна, тъй като s-орбиталата има сферична симетрия.
Тогава може да се очаква, че трите СН връзки в СН4 ще се окажат насочени p-връзки и точно еднакви, а четвъртата връзка е ненасочена s-s връзка и се различава от първите три.
Експерименталните данни обаче показват, че и четирите CH връзки в метановата молекула CH4 са еднакви и са насочени към върховете на тетраедъра (ъгълът между тях е 109,5 °).
Обяснението на този факт е дадено за първи път от американския химик Л. Полинг. Поради относителната близост на енергиите на 2s и 2p електроните, тези електрони могат да взаимодействат помежду си в процеса на образуване на химическа връзка с електрони на друг атом, давайки четири нови еквивалентни хибридни електронни облака.
Четири абсолютно идентични sp 3 -хибридни орбитали на въглеродния атом са разположени под ъгъл 109,5 ° една спрямо друга и са насочени към върховете на тетраедъра, в центъра на който е въглеродният атом
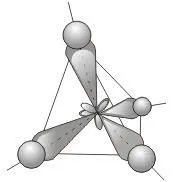
Това предизвиква по-силно припокриване на хибридни орбитали с орбиталите на електрони на други атоми в сравнение с припокриването на "обикновените" s- и p-орбитали и води до образуването на по-силни връзки.
Хибридизацията е характерна не само за съединениятавъглероден атом. Орбиталната хибридизация винаги възниква, когато електрони, принадлежащи към различни видове орбитали, участват в образуването на връзки.
Разгледайте примери за различни видове хибридизация на s - и p -орбитали. Хибридизацията на една s- и една p-орбитала (sp-хибридизация) възниква при образуването на халогенидни молекули на елементи от група II (Be, Mg, Zn и др.). Атомите на тези елементи в основно състояние имат два сдвоени s-електрона на външния слой. В резултат на възбуждане един от електроните на s-орбиталата преминава към p-орбитала, която е близка по енергия, т.е. появяват се два несдвоени електрона, единият от които заема s-, а другият p-орбитала. Когато възникне химическа връзка, тези две различни орбитали се превръщат в две еднакви хибридни орбитали (тип хибридизация - sp), насочени под ъгъл 180 ° една спрямо друга, т.е. тези две връзки са в противоположни посоки.
Експерименталното определяне на структурата на молекулите BeX2, Zn X2, HgX 2 и др. (X е халоген) показа, че тези молекули наистина са линейни.
Нека се спрем по-подробно на структурата на ацетиленовата молекула C2H2. В ацетиленовата молекула всеки въглероден атом е в sp-хибридно състояние, образувайки две хибридни връзки, насочени под ъгъл от 180° една спрямо друга. Както при С-С връзките, така и при С-Н връзките възниква общ двуелектронен облак, образуващ σ-връзки. σ-връзка е връзка, която възниква, когато електронните облаци на два атома са социализирани, ако облаците се припокриват по линията, свързваща атомите.
Но в молекулата на ацетилена всеки от въглеродните атоми съдържа още два р-електрона, които не участват в образуването на σ-връзки. Ацетиленовата молекула има плосък линеен "скелет", така че и двата p-електронни облака във всеки от въглеродните атоми стърчат отравнина на молекулата в посока, перпендикулярна на нея. В този случай също има известно взаимодействие на електронни облаци, но по-малко силно, отколкото при образуването на σ-връзки. В резултат на това в ацетиленовата молекула се образуват още две ковалентни въглерод-въглеродни връзки, наречени p-връзки
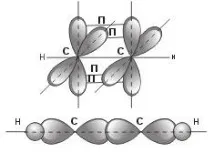
В общия случай p-връзка може да се нарече ковалентна връзка, образувана от припокриването на атомни орбитали извън линията, свързваща атомите.
σ-връзките са по-силни от p-връзките, което обяснява по-голямата реактивност на ненаситените въглеводороди в сравнение с наситените.
Друг вид хибридизация на s- и p-орбитали се извършва в съединения на бор, алуминий или въглерод (етилен, бензен). Възбуден борен атом има три несдвоени електрона - един s - и два p-електрона. В този случай, по време на образуването на борни съединения, възниква хибридизация на една s - и две p-орбитали ( sp 2 -хибридизация), докато се образуват три идентични sp 2 - хибридни орбитали, разположени под ъгъл от 120 ° една спрямо друга
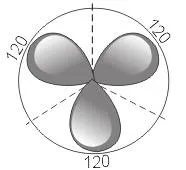
Наистина, експериментите показват, че съединения като B F 3, A lCl 3, както и етилен и бензен имат равнинна структура и всичките три B-F връзки, например, в молекулата B F 3 са разположени под ъгъл от 120 ° една спрямо друга.
Чрез образуването на sp 2 -хибридни орбитали се обясняват структурите на ненаситените въглеводороди с двойни връзки. Например, за молекула като етилен, следната структура
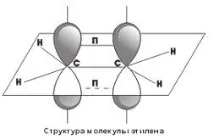
Както може да се види, всеки въглероден атом има σ-връзки, образувани от sp 2 хибридни облаци, освен това се образува p-връзка между въглеродните атоми поради припокриването на p-орбиталите. По този начин двойните връзки въглерод-въглерод се състоят от една σ- и една p-връзка.