Химични елементи Уикипедия
Химичен елементе колекция от атоми с еднакъв заряд на атомни ядра. Атомното ядро се състои от протони, чийто брой е равен на атомния номер на елемента, и неутрони, чийто брой може да бъде различен [1] . Всеки химичен елемент има свое собствено латинско име и химичен символ, състоящ се от една или двойка латински букви, регламентирани от IUPAC и са дадени по-специално в таблицата на Периодичната таблица на елементите на Менделеев [2] .
Формата на съществуване на химичните елементи в свободна форма сапрости вещества(едноелементни) [3] . Необходимо е да се прави разлика между химичните елементи (абстрактни обекти, описани чрез техните характеристики) и съответните им материални обекти - прости вещества (притежаващи определени физични и химични свойства) [4] .
Към 2016 г. са известни 118 [5] химични елемента. 94 от тях се срещат в природата (някои само в следи), а останалите 24 са изкуствено синтезирани.
Съдържание
Историята на формирането на концепцията
Думата "елемент" (лат. elementum) е използвана още в древността (от Цицерон, Овидий, Хораций) като част от нещо (елемент на речта, елемент на образованието и т.н.). В древността е била широко разпространена поговорката: „Както думите са съставени от букви, така и телата са съставени от елементи“. Оттук и вероятният произход на тази дума: от името на редица съгласни букви в латинската азбука:l, m, n, t("el" - "em" - "en" - "tum"). [6]
Концепцията за химически елемент, близка до съвременното разбиране, е отразена в новата система на химическата философия, изложена от Робърт Бойл в книгата "Скептичният химик" (1661). Бойл посочи, че нито четирите елемента на Аристотел, нито трите принципа на алхимиците могат да бъдат признати за елементи. Елементи споредБойл - практически неразложими тела (субстанции), състоящи се от подобни хомогенни (състоящи се от първична материя) корпускули, от които са съставени всички сложни тела и на които могат да бъдат разложени. Корпускулите могат да варират по форма, размер, тегло. Корпускулите, от които се образуват телата, остават непроменени при трансформациите на последните [7] .

Благодарение на Джон Далтън в началото на XIX век. в химията преобладава атомно-молекулярната хипотеза, разглеждаща химичния елемент като отделен вид атоми и посочваща природата на прости и сложни вещества, състоящи се съответно от атоми от един и същи или различни видове. Далтон за първи път посочва атомното тегло като най-важното свойство на елементите, което определя тяхната химическа природа. Благодарение на усилията на Йонс Берцелиус и неговите последователи, атомните тегла (атомни маси) на известните елементи са много точно определени. Средата на 19 век бе белязано от редица открития на нови елементи. На международния конгрес на химиците в Карлсруе през 1860 г. са приети дефиниции на понятията молекула и атом.
До момента на откриването на периодичния закон от Д. И. Менделеев (1869 г.) са били известни 63 елемента. Именно атомното тегло той изтъкна като свойство на атомите, което определя периодичността на промяната на свойствата на химичните елементи, както и на простите и сложните вещества, които те образуват. Менделеев определя химичните елементи като „материалните части на прости или сложни тела, които им придават определен набор от физични и химични свойства“. Откритието на Менделеев позволи да се предвиди съществуването, както и свойствата на редица неизвестни по това време елементи и послужи като научна основа за тяхната класификация.
Менделеев обаче беше принуден да направи няколко пермутации в последователността от разпределени елементиувеличаване на атомното тегло с цел поддържане на периодичността на химичните свойства, както и въвеждане на празни клетки, съответстващи на неоткрити елементи. По-късно (през първите десетилетия на 20 век) става ясно, че периодичността на химичните свойства зависи от атомния номер (заряда на атомното ядро), а не от атомната маса на елемента. Последното се определя от броя на стабилните изотопи на елемента и тяхното естествено изобилие. Стабилните изотопи на даден елемент обаче имат атомни маси, групирани около определена стойност, тъй като изотопите с излишък или дефицит на неутрони в ядрото са нестабилни и с увеличаване на броя на протоните (т.е. атомния номер), броят на неутроните, които заедно образуват стабилно ядро, също се увеличава. Следователно периодичният закон може да се формулира и като зависимост на химичните свойства от атомната маса, въпреки че в някои случаи тази зависимост е нарушена.
С откриването на изотопите стана ясно, че дори различни колекции от атоми на един и същи елемент могат да имат различни атомни маси; По този начин, поради преобладаването на изотопа 4 He, радиогенният хелий, изолиран от уранови минерали, има атомна маса, по-голяма от тази на хелия с космически лъчи (където лекият изотоп 3 He също присъства).
Съвременното разбиране на химичния елемент като съвкупност от атоми, характеризиращи се с еднакъв положителен ядрен заряд, равен на номера на елемента в периодичната система, се появи благодарение на фундаменталната работа на Хенри Моузли (1915) и Джеймс Чадуик (1920) [9] .
Известни химични елементи
Синтезът на нови (неоткрити в природата) елементи с атомно число, по-високо от това на урана (трансуранови елементи) е извършено за първи път чрез многократно улавяне на неутрони от уранови ядра в условия на интензивен неутронен потокв ядрени реактори и още по-интензивно - в условията на ядрен (термоядрен) взрив. Последващата верига от бета разпади на богати на неутрони ядра води до увеличаване на атомния номер и появата на дъщерни ядра с атомен номерZ>gt; 92 . Така бяха открити нептуний (Z= 93), плутоний (94), америций (95), беркелий (97), айнщайний (99) и фермий (100). Кюрий (96) и калифорний (98) също могат да бъдат синтезирани (и практически получени) по този начин, но те първоначално са открити чрез облъчване на плутоний и кюрий с алфа частици в ускорител. По-тежките елементи, като се започне с менделевия (101), се получават само в ускорители, чрез облъчване на актинидни мишени с леки йони.
Правото да предложат име за нов химичен елемент се предоставя на откривателите. Това име обаче трябва да отговаря на определени правила. Съобщението за ново откритие се проверява няколко години от независими лаборатории и ако бъде потвърдено, Международният съюз за чиста и приложна химия (IUPAC) официално одобрява името на новия елемент.
Неоткритите или неодобрените елементи често се наименуват с помощта на системата, използвана от Менделеев - с името на висшия хомолог в периодичната таблица, с добавяне на префиксите "eka-" или (рядко) "dvi-", което означава санскритските цифри "едно" и "две" (в зависимост от това дали хомологът е с 1 или 2 периода по-висок). Например, преди откритието, германий (стоящ под силиций в периодичната таблица и предсказан от Менделеев) се нарича ека-силиций, оганезон (унунокций, 118) също се нарича ека-радон, а флеровий (унунквадий, 114) се нарича ека-олово.
Класификация
Химически символиелементи
Символите за химичните елементи се използват като съкращения за имената на елементите. Като символ обикновено се взема началната буква от името на елемента и, ако е необходимо, се добавя следващата или една от следните. Обикновено това са началните букви на латинските имена на елементите: Cu - мед (cuprum), Ag - сребро (argentum), Fe - желязо (ferrum), Au - злато (aurum), Hg - живак (hydrargirum). Такава система от химически символи е предложена през 1814 г. от шведския химик Й. Берцелиус. Временните символи на елементите, използвани преди официалното одобрение на техните постоянни имена и символи, се състоят от три букви, което означава латински имена на три цифри в десетичната нотация на техния атомен номер (например ununoctium - 118-ият елемент - имаше временно обозначение Uuo). Използва се и системата за означение за висши хомолози, описана по-горе (Eka-Rn, Eka-Pb и т.н.).
По-малки числа до символа на елемента са посочени: горе вляво - атомната маса, долу вляво - поредният номер, горе вдясно - зарядът на йона, долу вдясно - броят на атомите в молекулата [9]:
| атомна маса | йонен заряд |
| сериен номер | брой атоми в една молекула |
- H 2 >>> е водородна молекула, състояща се от два водородни атома
- C u 2 +>>> - меден йон със заряд 2+
- 6 12 C_C>>> е въглероден атом с ядрен заряд 6 и атомна маса 12.
В периодичната таблица карта за химичен елемент обикновено включва следните характеристики:
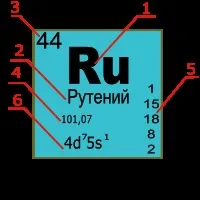
- 1— обозначение на химичен елемент.
- 2е българско име.
- 3—поредният номер на химичен елемент, равен на броя на протоните в атомното ядро.
- 4- атомна маса: средната стойност на атомната маса на стабилните изотопи в земната кора или атомната маса на най-дългоживеещия изотоп (за радиоактивни елементи).
- 5е разпределението на електроните по енергийни нива.
- 6- електронна конфигурация.
Разпространението на химичните елементи в природата
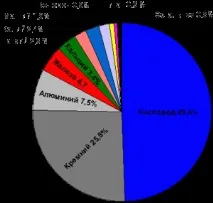
Съдържанието на елементи в земната кора се различава от съдържанието на елементи в Земята като цяло, тъй като химическият състав на кората, мантията и ядрото на Земята е различен. По този начин ядрото се състои главно от желязо и никел. На свой ред, изобилието на елементи в Слънчевата система и във Вселената като цяло също се различава от това на земята. Водородът е най-разпространеният елемент във Вселената, следван от хелий. Изследването на относителното съдържание на химични елементи и техните изотопи в космоса е важен източник на информация за процесите на нуклеосинтеза и еволюцията на Слънчевата система и небесните тела.
образование
Повечето от химичните елементи (94 от известните 118) са открити в природата (в земната кора), въпреки че някои от тях първоначално са били получени изкуствено (а именно: технеций Tc (сериен номер 43), прометий Pm (61), астат At (85), както и трансурановият нептуний Np (93) и плутоний Pu (94); тези пет елемента, след тяхното изкуствено създаване, са намерени в изчезващо малки количества в природата; те възникват като междинни ядра по време на радиоактивния разпад на уран и торий, както и по време на улавянето на неутрони от урана и последващия бета-разпад). Така в земната кора има (в много различни концентрации) всичките първи 94 елемента от периодичната таблица.
Сред тези 94 химични елемента,намерени в земната кора, повечето (83) са първични, илипървоначални; те произхождат от нуклеосинтезата в галактиката преди формирането на слънчевата система и тези елементи имат изотопи, които са или стабилни, или достатъчно дълготрайни, за да не се разпаднат през 4,567 милиарда години, които са изминали оттогава. Останалите 11 природни елемента (технеций, прометий, полоний, астат, радон, франций, радий, актиний, протактиний, нептуний и плутоний) са радиогенни - те нямат толкова дългоживеещи изотопи, така че всички естествени атоми на тези елементи, съществуващи в земната кора, са възникнали от радиоактивния разпад на други елементи [12] [13] .
Всички елементи, следващи плутоний Pu (сериен номер 94) в периодичната система на Менделеев, напълно отсъстват в земната кора [14], въпреки че някои от тях могат да се образуват в космоса по време на експлозии на свръхнова [източникът не е посочен 2089 дни] . Времето на полуразпад на всички известни изотопи на тези елементи е малко в сравнение с живота на Земята. Дългосрочните търсения на хипотетични природни свръхтежки елементи все още не са дали резултати.
Повечето химични елементи, с изключение на няколко от най-леките, са възникнали във Вселената главно в хода на звездния нуклеосинтез (елементи до желязо - в резултат на термоядрен синтез, по-тежки елементи - при последователно улавяне на неутрони от атомни ядра и последващ бета-разпад, както и в редица други ядрени реакции). Най-леките елементи (водород и хелий - почти изцяло, литий, берилий и бор - частично) са се образували в първите три минути след Големия взрив (първичен нуклеосинтез).
Един от основните източници на особено тежки елементи във Вселената трябва да бъде, според изчисленията, синтезът на неутрони.звезди, с освобождаване на значителни количества от тези елементи, които впоследствие участват във формирането на нови звезди и техните планети. [15]
Химичните елементи като съставна част на химикалите
Химичните вещества могат да се състоят както от един химичен елемент (просто вещество), така и от различни (сложно вещество или химично съединение).
Химическите елементи образуват около 500 прости вещества [16] . Способността на един елемент да съществува под формата на различни прости вещества, които се различават по свойства, се нарича алотропия. [16] В повечето случаи имената на прости вещества съвпадат с името на съответните елементи (например цинк, алуминий, хлор), но в случай на наличие на няколко алотропни модификации имената на просто вещество и елемент могат да се различават, например кислород (диоксиген, O2) и озон (O3); диамант, графит и редица други алотропни модификации на въглерода съществуват заедно с аморфните форми на въглерода.
При нормални условия 11 елемента съществуват под формата на газообразни прости вещества (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 - течности (Br и Hg), останалите елементи образуват твърди вещества.