Химия на експлозията - Бутоните на Наполеон
Движещата сила на експлозията е образуването на газове и бързото им разширяване под действието на реакционна топлина. Газовете заемат много по-голям обем от подобно количество твърди вещества или течности. Разрушителният ефект на експлозията се свързва с ударна вълна, причинена от много бърза промяна в обема на материята по време на образуването на газове. Ударната вълна, генерирана от експлозията на барут, се разпространява със скорост от няколкостотин метра в секунда, но в случай на по-мощни експлозиви (като тринитротолуен или нитроглицерин), скоростта на ударната вълна може да достигне шест хиляди метра в секунда.
Всяка експлозия отделя голямо количество топлина. Реакциите, придружени с отделяне на топлина, се наричат екзотермични. Голямо количество топлина допринася за активното разширяване на газовете: колкото по-висока е температурата, толкова по-голям е обемът на газовата смес. Отделянето на топлина се дължи на разликата между молекулите, разположени в двете части на уравнението на реакцията. Получените молекули (разположени от дясната страна на уравнението) имат по-малко енергия, съхранена в техните химични връзки, отколкото оригиналните молекули (разположени отляво). Получените вещества са по-стабилни. По-специално, в реакциите на експлозия на нитро съединения се образува изключително стабилна азотна молекула N 2. Стабилността на тази молекула е свързана със силата на тройната връзка, свързваща двата азотни атома.
Структурата на молекулата на азота
Силата на тройната връзка означава, че е необходима много енергия, за да се разруши. Напротив, когато се образува тройна връзка, се освобождава голямо количество енергия, което се случва при експлозия.
В допълнение към образуването на газове и отделянето на топлина, третото важно свойство на реакциите на експлозия е тяхната висока скорост. Ако реакцията протича бавно, отделената топлина ще има време да се разсее и газътдифундира в околната среда, без да оказва значително налягане и без да причинява разрушителна ударна вълна. Необходимият за реакцията кислород трябва да се съдържа в самия експлозив. Атмосферният кислород не може да се използва поради причината, че не може да реагира достатъчно бързо. Поради тази причина нитро съединенията, в които азотът и кислородът са свързани заедно, често са експлозивни, докато други съединения, съдържащи азот и кислород, които не са свързани помежду си, не са.
Горното може да се илюстрира с примера на изомери. Както вече знаем, изомерите са вещества с еднаква химична формула, но различни структури. Лоро-нитротолуенът и пара-аминобензоената киселина с една и съща химична формула C 7 H 7 NO 2 имат по седем въглеродни атома, седем водородни атома, един азотен атом и два кислородни атома, но атомите в тези две молекули са разположени в различна последователност.
Пори- или n-нитротолуен (префиксът пори означава, че групите CH 3 и NO 3 са в противоположни позиции в пръстена) може да експлодира, докато n-аминобензоената киселина изобщо не е експлозивна. Може дори да сте го втривали в кожата си през лятото: n-аминобензоената киселина или PABA е активната съставка в много слънцезащитни продукти. Вещества като PABA абсорбират ултравиолетовата светлина точно с дължината на вълната, която е най-вредна за кожните клетки. Поглъщането на светлина с определена дължина на вълната е свързано с наличието в молекулата на редуващи се единични и двойни връзки, както и на кислородни и азотни атоми. Промяната на броя на връзките или атомите в такива структури променя дължината на вълната на абсорбираната светлина. Има други вещества, които абсорбират светлина при определени дължини на вълната, които могат да се използват.като част от слънцезащитни кремове, при условие че не се отмиват много бързо с вода, не са токсични, не предизвикват алергии, нямат неприятен вкус или мирис и не се разлагат на слънце.
Експлозивността на съединенията, съдържащи нитро групи, зависи от броя на тези групи. Нитротолуенът има само една нитро група. По-нататъшното нитриране може да доведе до добавянето на още една или две нитро групи, за да се образува съответно ди- или тринитротолуен. Въпреки че нитротолуенът и динитротолуенът могат да експлодират, те не предизвикват толкова силна експлозия, колкото тринитротолуенът (TNT, TNT).
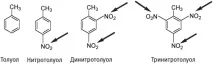
Нитро групите са показани със стрелки
Нови експлозиви започват да се появяват през 19 век, когато химиците започват да изучават взаимодействието на азотната киселина с органичните съединения. Няколко години след като Фридрих Шьонбайн съсипа престилката на жена си, италианският химик Асканио Собреро, работещ в Торино, синтезира ново експлозивно нитро съединение. Sobrero изследва ефекта на азотната киселина върху някои органични вещества. Той постави глицерин, който лесно се изолира от животинска мазнина, в охладена смес от сярна и азотна киселина и след това изля получената смес във вода. Образува се слой мазна течност, която сега се нарича нитроглицерин. Тогава той извърши манипулация, която беше традиционна за онези времена и немислима днес: той опита ново вещество и написа, че „следа от вещество, поставено върху езика, но не погълнато, причинява множество пулсации, силно главоболие и слабост в крайниците.“
По-късно проучване на причините за силно главоболие при работници, заети в производството на експлозиви, показа, че главоболието е свързано с разширяването на кръвоносните съдове под действието на нитроглицерин. В резултат на това започва да се използва нитроглицеринкато лек за ангина пекторис.
Разширяването на стеснените съдове, кръвоснабдяващи сърдечния мускул, осигурява нормално кръвоснабдяване и облекчава болката. Сега е известно, че в тялото молекула азотен оксид NO се отделя от нитроглицерина, което причинява вазодилатация. Изследването на ефектите на азотния оксид доведе до разработването на лекарството за импотентност, виагра, което също разчита на вазодилатиращите свойства на NO.
Освен това в тялото азотният оксид участва в поддържането на кръвното налягане, предаването на междуклетъчни сигнали, формирането на дълготрайна памет, а също и в храносмилането. Въз основа на тези изследвания са създадени лекарства за нормализиране на кръвното налягане при новородени и за лечение на пациенти след инсулт. През 1998 г. Робърт Фърчгот, Луис Игнаро и Ферид Мурад получават Нобелова награда за медицина за откриването на ролята на азотния оксид в организма. По ирония на съдбата самият Алфред Нобел, който натрупа богатството си в производството на динамит от нитроглицерин, което му позволи да учреди Нобеловата награда, отказа да се лекува с нитроглицерин. Умира от ангина пекторис, без да вярва, че нитроглицеринът може да лекува. Той вярваше, че това вещество може да причини само главоболие.
Нитроглицеринът е много нестабилна молекула. Експлодира при нагряване или силен удар.
В резултат на експлозията се образуват облаци от бързо разширяващи се газове и голямо количество топлина. За разлика от барута, който развива налягане от шест хиляди атмосфери за хилядна от секундата, експлозия на еквивалентно количество нитроглицерин за една милионна от секундата създава налягане от двеста и седемдесет хиляди атмосфери. Барутът е сравнително безопасен за работа, но нитроглицеринът се държи изключителнонепредсказуем. Той може да експлодира спонтанно при разклащане или нагряване. Ето защо хората трябваше да намерят надежден и безопасен начин да се справят с това упорито вещество, както и начин да го детонират.