КАТАЛИЗА НА КИСЕЛИНАТА НА ЛУИС
Още на много ранен етап от създаването на своята теория за валентността Луис вярва, че молекулите с дефицит на електрони (сега често наричани киселини на Луис) могат да се прикрепят към молекули, които имат несподелена двойка електрони по същия начин като протона. В своята статия от 1938 г. [48] той посочи, че оцветени молекули като диметиламиноазобензен, цианин и триарилметанови багрила в много сухи разтворители под действието на SnCl4 проявяват същите промени в цвета, както при действието на протонни донори като HC1. През 1943 г. Lewis и Bigeleisen [49] в много задълбочена работа показаха, че в разтвори на ацетонитрил или бензонитрил SnCl4 реагира с метиленово синьо, за да образува продукт, който по отношение на своя спектър на поглъщане във видимата и ултравиолетовата област е подобен на продукта от добавянето на протон към молекулата на това багрило. Същата картина се наблюдава в ацетонови разтвори на ВС13. Системите бяха старателно изсушени и във всеки случай пълната хидролиза на SnCl4 няма да даде НС1 в количество, достатъчно да обясни
възникващи спектрални промени чрез добавяне на протон.
По този начин тук добавянето и добавянето на протон имат същия ефект върху количеството енергия, което се абсорбира по време на електронния преход, отговорен за цвета на веществото. Това означава, че добавянето и добавянето на протон води до същите промени в разпределението на електронната плътност в сложна молекула. Следователно, трябва да се очаква, че киселините на Луис катализират реакции, които се катализират от протонни донори; в някои случаи такава катализа действително се наблюдава.
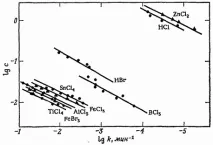
Ориз. 10.6. Влияние на концентрацията на различни катализатори върху специфичната скорост на деполимеризация на паралдехид [50].
Например Бел и Скинър [50] установиха, че киселините на Луис катализират деполимеризацията на паралдехид (цикличен тример на ацеталдехид) толкова ефективно, че скоростта на реакцията в разтвори на хлоробензен или анизол не може да бъде измерена с конвенционални методи. Въпреки това, кинетиката на реакцията е лесна
изследване в етерен разтвор (фиг. 10.6). Деполимеризацията е от първи порядък по отношение на паралдехид и втори порядък по отношение на катализатор, както по отношение на киселини на Луис, така и по отношение на солна или бромоводородна киселина. Малки количества вода имат инхибиторен ефект и следователно катализът не може да се обясни с образуването на силен протонен донор чрез реакцията
От друга страна, в много реакции киселините на Луис имат ефективен каталитичен ефект само в присъствието на малки количества вещества, които при взаимодействие с киселините на Луис образуват силни протонни донори. Такъв е например случаят при полимеризацията на изобутилен [51]. Вода и могат да действат като катализатори катализатори или промотори; водата действа по реакция от типа (XIII), и по реакция от вида
където B е всяко вещество с основни свойства, включително реагента. Необходимостта от използване на промотори в такива реакции на полимеризация очевидно все още не е напълно разбрана [52].