Материал от сайта, Формалдехид
Как да се отървем от формалдехида за 2 часа?!
Материал от xumuk.ru
ФОРМАЛДЕХИД (формалдехид, метанал), HCHO, мол. т. 30,3; безцветен газ с остър дразнещ мирис; т.т. -118°С, т.к -19,2°С; 0.9172, 0.8153, плътен по въздух 1,04; tcrit 137.2-141.2°C, pcrit 6.784-6.637 MPa; уравнение за температурната зависимост на налягането на парите в диапазона от -109 до -22 0 C: lg r (Pa) = 9,2817 - 959,437 (243,39 + t); 35.4 J / (mol K), 23.31 kJ / mol (19 0 C), DH 0 изгаряне-561.5 kJ / mol, -115.9 kJ / mol, 218.8 J / (mol K).
Чистият газообразен формалдехид е относително стабилен при 80-100 0 C, при температури под 80 0 C бавно полимеризира; процесът се ускорява при наличие. полярни разтвори (включително вода), к-т и основи.
Формалдехидът е лесно разтворим. във вода, алкохоли и други полярни разтвори. При ниски температури се смесва във всяко съотношение с неполярни разтворители: толуен, диетилов етер, етилацетат, CHCl3 (с увеличаване на t-ry, разтворът намалява), а не сол. в петролев етер. Водните разтвори на формалдехид съдържат равновесна смес от CH2 (OH) 2 монохидрат (99,9%), нестабилна в свободен вид. състояние и полимерни хидрати HO (CH2O) nH (n = 2-8), стабилни кристални. връзки. Когато продължите. съхранение на водни разтвори (особено при ниски температури) и когато се концентрират, степента на полимеризация се увеличава. За съхранение на водни разтвори на формалдехид те се стабилизират с метанол (виж Формалин). При изпаряване на водни разтвори във вакуум се образува параформ или параформалдехид-хид (CH2O) n (n \u003d 8-12), под действието на алкали върху конц. водна р-ра - т.нар. а-полиоксиметилен (n> 100). Полимеризацията в неполярен разтворител води до полиформалдехид (n> 1000).
Параформ - безцветен. кристали с мирис на формалдехид, т.н. 120-170 0 С, инв студена вода се разтваря бавно, в гореща вода бързо, образувайки разтвори на формалдехид, слабо разтворим. в ацетон; горими, т. 720°С.
известна цикличност. формалдехидни полимери: триоксан (формула I, т.т. 64°С), получен чрез дестилация на 60% воден разтвор на формалдехид с разл. H2SO4 и тетраоксиметилен (f-la II, т. пл. 112 0 C), образувани по време на нагряване. диацетат високо мол. полиоксиметилен.
Формалдехидът е силно реактивен. Възстановен H2 в присъствието. много метали или техни оксиди (например Ni, Pt, Cu) в метанол; окислени HNO3, KMnO4 до мравчена киселина или CO2 и H2O; обсажда мн метали (Ag, Pt, Au, Bi и др.) от разтворите на техните соли, докато се окисляват до мравчена киселина.
С наличие на алдехиди. силни алкали формалдехид навлиза в т.нар. кръстосано деление Cannizzaro (C6H5CHO + HCHO C6H5CH2OH + HCOONa); с ацеталдехид в присъствието. Ca (OH) 2 образува пентаеритритол, в парна фаза при 285 0 C - акролеин; под действието на алкохолати Al или Mg, формалдехидът претърпява диспропорциониране, за да образува метилфомат (виж реакцията на Тишченко).
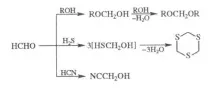
P-ция на формалдехид с алкохоли в присъствието. силна to-t води до ацетали (формали), с H2S - до циклични. трициан, с HCN в присъствието. алкали - до цианохидрин:
Формалдехидът се добавя към олефините в присъствието. киселинни катализатори за образуване на 1,3-дигликоли и 1,3-диоксани (виж реакцията на Prins), p-ция на формалдехид с изобутилен дава изопрен, кондензация на течна фаза с пропилей в присъствието. BF3 или H2SO4 е бутадиен. От формалдехид и кетен в промишлеността се получава b-пропиолактон.
Р-ция на формалдехид с ацетилен - обн. метод за получаване на бутадиен (виж Реакции на Repe), с взаимодействие. две молекули формалдехид с ацетилен се образува 2-бутин-1,4-диол.
В присъствието варформалдехидът се превръща във въглехидрати:
При взаимодействие формалдехид с NH3 образува хексаметилентетрамин, с първични амини - тримери, с вторични - бис- (ди-алкиламино) метани:
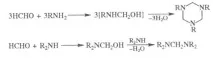
Комуник. с подвижен водороден атом реагират с формалдехид и NH3 (или амини) съгласно реакцията на Маних. Р-ция на формалдехид с NH4Cl пром. метод за получаване на метиламин: 2HCHO + NH4Cl CH3NH2 HCl + HCOOH (р-цията може да продължи с образуването на ди- и триметиламини). С урея в алкална среда формалдехидът дава моно- и диметилолни производни, поликондензацията на които произвежда урея-формалдехидни смоли, а от меламин и формалдехид - меламино-формалдехидни смоли.
Ароматни конн. (бензен, анилин, толуен) образуват съответните диарилметани с формалдехид; в присъствие HCl бензенът е хлор-метилиран с формалдехид чрез реакцията на Blanc, образувайки бензил хлорид; сфеноли в присъствието. to-t или бази формалдехидът се кондензира с образуването на орто- и пара-метилолни производни, които допълнително се превръщат във фенолформалдехидни смоли. Продуктите от кондензацията на формалдехид с фенол и нафталинсулфонови киселини се използват като дъбилни средства (неразол и др.).
В промишлеността формалдехидът се окислява. дехидрогениране на метанол в парната фаза на въздух O2 в присъствието. Ag при 680-720°С (конверсия на метанол 97-98%) или в присъствието. Ag или сребърна мрежа при 600-650 0 C (конверсия 77-87%) с връщане на нереагиралия метанол в рецикла. Процесът може да се проведе в излишък на въздух в присъствието. метални оксиди (Fe-Mo-V) при 250-400 0 C (98-99% превръщане). Формалдехидът може да се получи чрез окисление на метан, пропан, бутан, етилен, хидрогениране на CO, но тези методи нямат пром. икономически ценности. причини.
В лабораторията Формалдехидът се получава чрез дехидрогениране на метанолнад мед, термичен разлагане на цинков формиат, деполимеризация на параформа.
За откриване на формалдехид използвайте реактива на Шиф или p-цията на формалдехид с фенилхидразин K3[Fe(CN)6] в алкална среда (червен цвят). Формалдехидът се определя йодометрично или с последния се използва р-ция на формалдехид с Na сулфит. титруване на освободената основа до едно: HCHO + Na2SO3 HOCH2SO3Na + NaOH, както и течна хроматография и др. методи.
Формалдехидът се използва в орг. синтез, в производството на синтет. смоли и пластмаси, за синтеза на много други. лек. в-в и багрила, за дъбене на кожа, като дезинфектант, антисептик. и дезодорант.
Формалдехидът е токсичен, причинява дегенеративни процеси в паренхимните органи. Силен ефект върху нервната система, очевидно поради наличието на примеси на метанол в тех. формалдехид или превръщането на формалдехид в тялото в метанол и мравчена киселина. В същото време се смята, че формалдехидът бързо се окислява в тялото до CO2 (с 70-80%).
MPC в атм. въздух 0,003 mg / m 3, във въздуха на работната зона 0,5 mg / m 3, във водата на водоеми за битови нужди 0,05 mg / l. Т. самозапалващ се 430°С, CPV при 20°С 7-72% (по обем).
Световно производство на формалдехид прибл. 5 милиона тона годишно (1980), от които 28% в САЩ, 17% в Германия и 12% в Япония.