Обща характеристика на металите от основната подгрупа на II група
Химични елементи, включени в основната подгрупа на II група: алкалоземни метали - калций, стронций, барий и радий. Какъв е произходът на това име? Хидроксидите на тези елементи - силни основи - са подобни по свойства на хидроксидите на алкални метали; техните оксиди са огнеупорни и приличат на оксиди на алуминий и някои тежки метали (такива оксиди преди са били наричани "земи"). Оттук и името "алкалоземни метали".
Имаме мини-лаборатории, задачи бяха дадени предварително, където учениците трябваше да проведат изследване на някои вещества, свързани с живота (например магнезий и калций).
Елементи, включени в основната подгрупа на II група: алкалоземни метали - калций, стронций, барий и радий. Какъв е произходът на това име? Хидроксидите на тези елементи - силни основи - са подобни по свойства на хидроксидите на алкални метали; техните оксиди са огнеупорни и приличат на оксиди на алуминий и някои тежки метали (такива оксиди преди са били наричани "земи"). Оттук и името "алкалоземни метали".
Имаме мини-лаборатории, задачи бяха дадени предварително, където учениците трябваше да проведат изследване на някои вещества, свързани с живота (например магнезий и калций).
Преглед на съдържанието на документа „Обща характеристика на металите от основната подгрупа на II група. Калций и магнезий, твърдост на водата
Лектор: Бейсембина Р.Н.
Тема:Обща характеристика на металите от главната подгрупа на II група. Калций и магнезий, твърдост на водата.
„Силата и силата на науката е в множеството факти, целта е в обобщаването на това множество“D. И. Менделеев
Цел на урока:Научете за най-важните съединенияCa и Mg, тяхното присъствие в природата, тяхното приложение, ефектът на тези метални йони върху качеството на водата.Цели:
Да се формират знания и умения за характеризиране на химичните елементи според тяхното място в PSCE, умение за работа с текст, подчертаване на съществените признаци и свойства на обекти, класифициране на факти, анализиране, сравняване, обобщение, правене на изводи; изучават химичните свойства на алкалоземните метали;
Образователни: да покаже значението на химическите знания за съвременното високотехнологично производство и успешната адаптация на бъдещите специалисти в съвременното общество.
да развие познавателен интерес, комуникативни качества, способност за самостоятелно действие, да продължи формирането на химичен език.
позволяват да се запази здравето на учениците, да се формира тяхното здравно ориентирано съзнание.
Форми на работа - индивидуална, групова, самостоятелна работа с източници на информация Оборудване: колекции от калциеви, магнезиеви съединения, интерактивна дъска.
1. Анкета на домашната работа.(Тест 3мин.)
2. Актуализиране на знанията. Съобщение за целта на урока.
3. Изучаване на нов материал (30 минути)
5. Домашна работа (1 мин.)
Учител: Днес ще се запознаем със съединенията на елементите от втората група на основната подгрупа, използвайки примера на калция и магнезия.
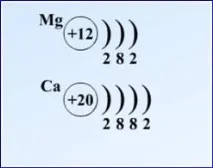
Учител.Химични елементи, включени в основната подгрупа на II група: алкалоземни метали - калций, стронций, барий и радий. Какъв е произходът на това име? Хидроксидите на тези елементи - силни основи - са подобни по свойства на хидроксидите на алкални метали; техните оксиди са огнеупорни и приличат на оксиди на алуминий и някои тежки метали (такива оксиди преди са били наричани "земи"). Оттук и името „алкалоземниметали."
Имаме мини-лаборатории, задачи бяха дадени предварително, където учениците трябваше да проведат изследване на някои вещества, свързани с живота (например магнезий и калций).
Изследователска лаборатория #1.
Тема на изследването: „Магнезий“
Цел:Съставете доклад за магнезий според получените елементи от учебния план.
1) Подгответе историческа бележка за откриването на магнезия.
2) Обяснете физичните свойства на метала: ковкост, топлинна и електрическа проводимост въз основа на структурата на кристалната решетка.
3) Получаване на магнезий (работа с учебник).
4) Определете областите на разпространение на магнезий в природата.
Решаване на проблеми (за 2 отбора)
Експеримент:как портокаловият сок променя цвета на индикаторите - метилоранж и фенолфталеин. Сравнете цвета на получените разтвори с индикаторната скала. Обяснете какво се случва. Какво мислите: какви са последствията от излагането на тази напитка върху зъбния емайл?
(Розовият лакмус и безцветният фенолфталеин са показателни за кисела среда, в която емайлът става мек и лесно ерозира поради загуба на Ca2+). )– За да проверитеколко естествен е сокът,трябва да го сварите с лъжица сода (методът работи за напитки с кафяв, зелен или жълт цвят). Ако сокът остане със същия цвят, имате постижение в химическата индустрия. Ако е кафяв, продуктът е натурален. След като направихме експеримент с портокалов сок, установихме, че той не е променил цвета си, което означава, че не е естествен.
Отговорете с да или не.
1. Страдате ли от остеопороза (чупливи кости)? 2. Имате ли алергии при продължителни престоина слънце? 3. Имате ли често гърчове? 4. Пиете ли по-малко от 1 чаша мляко дневно? 5. Ядете ли малко млечни продукти като кисело мляко или сирене? 6. Пиете ли кола всеки ден? 7. Ядете ли малко зелени зеленчуци? 8. Ядете ли много месо и колбаси?
Ако сте отговорили с „не“ на повечето въпроси, значи тялото ви е достатъчно снабдено с калций.
1. Често ли имате крампи (особено нощни крампи на прасците)? 2. Страдате ли от болки в сърцето, сърцебиене и сърдечни аритмии? 3. Чувствате ли често изтръпване, например в ръцете? 4. Често ли сте заплашени от стресови ситуации?
Ако сте отговорили с „не“ на повечето въпроси, значи тялото ви е достатъчно снабдено с магнезий.
Изследователска лаборатория #2.
Изследователска тема: „Калций“.
Цел:Съставете доклад за калций според получените елементи от плана за изследване.
1) Подгответе историческа бележка за откриването на калций.
2) Обяснете физичните свойства на метала: ковкост, топлинна и електрическа проводимост въз основа на структурата на кристалната решетка
3) получаване на калций (работа с учебник)
4) Определете областите на разпространение на калций в природата.
6) решаване на проблеми
твърдост на водата (видове твърдост)
Твърдостта на водата се дължи на калциеви и магнезиеви йони. Природната вода винаги съдържа магнезиеви и калциеви соли. Нека сравним свойствата на твърдата и безсолна дестилирана вода. Добавете сапунен разтвор към колбите с твърда и дестилирана вода. Затворете колбите и ги разклатете. В колба с дестилирана вода се образува обилна пяна. В колба с твърда вода, неразтворими във вода калциеви съединения имагнезий. Ето защо сапунът не се пени в твърда вода.
7) премахване на твърдостта.
Начини за премахване на твърдостта на водата (видове методи).
Калциевите и магнезиевите соли се разтварят в естествена вода. Това са въглеводороди и сулфати. Ще покажем два метода за утаяване на хидрокарбонати за намаляване на твърдостта на водата. Първият начин е кипене. Кипенето* превръща разтворимите въглеводороди в неразтворими карбонати и твърдостта на водата намалява.
Вторият начин е да добавите варна вода. Когато се добави варна вода, бикарбонатите се превръщат в карбонати и водата става по-мека.
Но твърдостта на водата зависи и от калциевите и магнезиевите сулфати. Калциевите и магнезиевите сулфати могат да бъдат отстранени с натриев карбонат. Когато се добави натриев карбонат, сулфатите се превръщат в неразтворими калциеви и магнезиеви карбонати.
Сега знаем как да намалим твърдостта на водата. Котленият камък вътре в чайника е утайка от калциеви и магнезиеви карбонати, смесени с калциев сулфат. Котленият камък може да се отстрани от стените с помощта на разреден разтвор на оцетна киселина.
Калций- Калциевите йони са необходими за процеса на хематопоеза, метаболизъм, за намаляване на съдовата пропускливост, нормален растеж на скелета, имат благоприятен ефект върху състоянието на нервната система, имат противовъзпалителен ефект.
- Какво е общото в структурата на атомите на металите от II А подгрупа?
- Как се променя структурата на атома и химичните свойства на металите от магнезия към радия?
- Какви свойства, окислителни или редуциращи, проявяват металите от II група на основната подгрупа?
- С какви вещества могат да реагират металите от II група?
И така, берилият, магнезият и всички алкалоземни метали взаимодействат при нагряване с почти всички неметали - хлор, сяра, азот,водород и др., образувайки съответно хлориди, сулфиди, нитриди, хидриди.
Демонстрация на изгаряне на магнезий
Проблемна ситуация.Въглеродният диоксид не поддържа горенето, водата се използва за гасене на пожари. Може ли горящият магнезий да се гаси с вода или въглероден диоксид? Демонстрационен експеримент. Внасяме горящ магнезий във водата и гледаме как той изгаря, мигайки ярко. Обсъждаме причините за това явление, записваме уравненията на химичните реакции. Магнезият възстановява неметалите от оксиди. Горящият магнезий не може да се гаси не само с вода, но и с въглероден диоксид, с който реагира:
2Mg + CO2 = 2MgO + C (и също CO)
От всички метали от основната подгрупа на II група само берилият практически не взаимодейства с вода (защитен филм на повърхността му го предотвратява), магнезият реагира при нагряване, останалите метали взаимодействат с водата при нормални условия.
Метали от група IIA на периодичната таблица D.I. Менделеев са в състояние да изместят по-малко активните метали от техните оксиди. На това свойство се основава един от пирометалургичните методи за получаване на метали - металотермията. Най-често използваните редуциращи агенти са магнезий и калций. Например ниобий, тантал, молибден се получават чрез магнезиева термия. Калциотермия - почти всички редкоземни метали, хром, цирконий, ванадий и др.
Изгаряне на калций във въздуха
Калцият е сребристобял много твърд метал. Поради високата си химическа активност, той се съхранява под слой керосин. За да се запали калций във въздуха, е необходима много висока температура. В присъствието на кислород калцият се запалва при по-ниски температури. Екстрахирайте калций от керосин, попийте керосина с филтърна хартия. Потопете парче калций в разтопен калиев нитрат. Както е известно,калиевият нитрат при нагряване се разлага с отделяне на кислород:
Нека внесем калций заедно с малко количество калиев нитрат в пламъка на горелката. Калцият се запалва с керемиденочервен пламък. Основният продукт от изгарянето на калций във въздуха е калциевият оксид:
Напишете реакционни уравнения, потвърждаващи тяхната връзка или генетична връзка
Учител: Нека се обърнем към веригата от трансформации:Учител: Как се наричат тези вещества?
CaO - калциев оксид, негасена вар; Ca (OH) 2 - калциев хидроксид (гасена вар, варна вода, варно мляко, в зависимост от концентрацията на разтвора). Общи - същата химична формула Ca (OH) 2. Разлика: варовата вода е прозрачен наситен разтвор на Ca (OH) 2, а варното мляко е бяла суспензия на Ca (OH) 2 във вода.
CaCl2 - калциев хлорид, калциев хлорид; CaCO3 - калциев карбонат, креда, черупчести мрамор, варовик CaS04 ∙ 2H20 - калциев сулфат хидрат, гипс; MgO-
Mg (OH) 2 - MgC03 ∙ CaC03 - двойна сол - калциев карбонат, магнезий - доломит; MgC03 - магнезиев карбонат - магнезит; MgS04 - магнезиев сулфат - горчива или английска сол, открита в морската вода.
Верни ли са тези твърдения?
1. Всички алкалоземни метали са открити през 19 век.
2. Името на магнезия идва от името на града.
3. Радият е единственият радиоактивен елемент в своята група.
4. При нормални условия берилият не взаимодейства с водата.
5. Физичните свойства на металите зависят от структурата на кристалната решетка.
6. Калцият е от особено значение за живите организми