Растежни фактори и техните рецептори при рак на простатата - Тумори на пикочно-половата система -
Растежни фактори и teir рецептори при рак на простатата G.O. Hellawell и S.F. Брустър Отделение по урология, болница Чърчил, Оксфорд, Обединеното кралство
Ракът на простатата бързо се превръща в най-честата злокачествена неоплазма сред населението на развитите страни. В Европа това е втората водеща причина за смърт при мъже с всякакъв вид рак (1). При липса на скринингови програми и програми за ранно откриване на рак на простатата при много мъже заболяването придобива нелечима метастатична форма. Хормоналната терапия е най-ефективното лечение за нелокализиран рак, но може да контролира заболяването само за ограничен период от време, тъй като неизбежно се развива андрогенна независимост (2). При лечението на някои пациенти химиотерапията има краткотраен ефект и поради това има спешна необходимост от разработване на нови стратегии за лечение. За да направите това, трябва да разберете как клетките, засегнати от рак на простатата, стават нечувствителни към андрогените - придобиват андрогенна независимост. Има натрупване на данни, потвърждаващи участието на растежни фактори в развитието и прогресията на рака на простатата.
Установено е, че няколко онкогенни туморни пролифериращи продукта са хомоложни на растежни фактори, рецептори на растежен фактор или молекули в импулсните пътища на тези рецептори. Няколко семейства растежни фактори участват в растежа на здрави и ракови простатни клетки (3-32).
Растежни фактори при здрава и ракова простата.
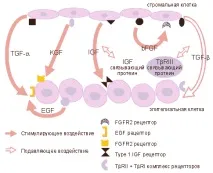
Семейство IGF, EGF, TGF-a, семейство фибробластен растежен фактор (FGF), ендотелни растежни фактори (тромбоцитен растежен фактор,PDGF и съдов ендотелен растежен фактор, VEGF) са основни стимулиращи регулатори на пролиферацията на простатни клетки. Семейството TGF-b представлява основната група фактори, които инхибират клетъчния растеж. Факторите на растеж имат автокринни и паракринни ефекти върху стромалните и епителните клетки и взаимодействат с други фактори и свързващи протеини, за да контролират растежа на простатните клетки (Фигура 1) (33).
Фактори на растежа и техните рецептори, участващи в развитието на нормална простата
Добрите животински модели за изследване на рака на простатата не са достатъчни, особено липсват модели, които имитират всички стадии на заболяването. Моделите на ксенотрансплантат (човешка тъкан, трансплантирана в реципиент с имунен дефицит), които използват или клетъчни линии, или трансплантируеми тумори, са полезни, но те по същество заобикалят ранното развитие на тумора, тъй като туморът се трансплантира в напреднал стадий на рак. PC-82 и PC-EW са андроген-зависими ксенотрансплантирани линии на рак на простатата. Те са полезни за изследване на регулацията на андрогенните рецептори (39). Прогресирането на линията на ксенографта CWR22 до андрогенна независимост in vivo прави този модел полезен за изучаване на прогресията на рак на простатата при хора (40). Има множество модели на гризачи за рак на простатата. Най-известният е моделът на плъх Dunning R-3327 на аденокарцином на простатата, тумор, получен от простатата на плъх от Копенхаген (41). От този клетъчен модел са разработени вторични клетъчни линии, които имитират андроген-зависимо заболяване, не-андроген-зависимо заболяване и метастатичната форма на заболяването. Наскоро бешее разработен модел на трансгенна мишка, който насочва експресията на ранния ген SV40 (Tag) към простатния епител (42). Поради променливото поведение на рака на простатата, винаги ще бъде трудно да се свърже точно заболяването при животински модели с това как се развива при хората. Наличните днес модели са далеч от това как се развива ракът при хората, но позволяват да се изследват последователните етапи в развитието на рака на простатата при хората.
IGF оста е съставена от лиганди (IGF-I и IGF-II), рецептори (IGF-1R и IGF-2R), най-малко шест свързващи протеина (IGFBP-1-6) и свързващи протеинови протеази (Фигура 2).
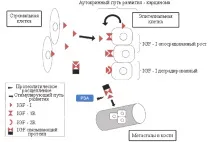
Стромалните клетки вероятно са основният източник на инсулиноподобни растежни фактори in vivo. Те засилват растежа на епителните клетки чрез паракринен ефект. Производството на инсулиноподобни растежни фактори от епителните клетки на простатата е една от промените, които настъпват едновременно с развитието на рак на жлезата (47). IGF-1R се експресира в епителни клетки, отгледани от нормална простата, доброкачествена хиперплазия на простатата и ракова органна тъкан (3, 4, 48). Проучване на човешки клетъчни линии от рак на простатата показа, че нивата на IGF-1R са по-високи в андроген-зависимите клетки, отколкото в андроген-нечувствителните клетки (4). Намаляването на IGF-1R с пептидни аналози потиска растежа на клетъчни линии на рак на простатата (49).
Нормалните и злокачествените простатни епителни клетки произвеждат свързващи протеини с инсулиноподобен растежен фактор (IGFBP), които могат да модулират митогенната активност на инсулиноподобни растежни фактори (55). IGFBP-3 се свързва>90% от циркулиращите инсулиноподобни растежни фактори и общо ¾1% от инсулиноподобните растежни фактори циркулират в свободна форма (56). Доказано е, че свръхекспресията на инхибиторния IGFBP-4 пречи на инициирането/образуването на тумор на простатата (57). Добре характеризиран серумен маркерен ген за рак на простатата, PSA, е протеаза за IGFBP-3 (7). PSA разцепва основния серумен IGFBP-3, намалявайки афинитета на IGFBP-3 за свързване на инсулиноподобни растежни фактори и създавайки благоприятни условия за взаимодействие на IGF-1 с IGFR-1. Раковите клетки на простатата отделят също катепсин D и плазминогенен активатор от урокиназния клас, които се държат подобно на свързващите протеини (BP) протеази (58, 59). Това повишава биоактивността на инсулиноподобните растежни фактори в местата на производство на IGFBP и може да обясни склонността към костни метастази с прогресията на рака на простатата.
EGF упражнява своите ефекти чрез споделен рецептор с TGF-a (60); EGF и TGF-a са структурно сходни и следователно са сходни един с друг по отношение на способността си да свързват и регулират EGFR (рецептор на инсулиноподобен растежен фактор) (61). Здравата простата съдържа огромно количество EGF, произведен от епителните клетки (62). Първоначалните тъканни култури на нормални човешки епителни клетки изискват EGF като средство за нормален растеж (63). Имунохистохимичните учени са идентифицирали основно стромалните клетки в нормалната тъкан на простатата като място за производство на TGF-α. Селективността на отговора на епителните клетки към паракринния стромален TGF-α и неавтокринен EGF доведе до предположението, че EGFR е разположен на базолатералната повърхност.клетки, докато силните връзки на епителните клетки пречат на луминалния EGF да достигне до рецепторите (9).
Експресията на EGF в простатната жлеза се контролира от андрогени. При модели на гризачи, в резултат на кастрация, нивата на EGF намаляват и нивата на EGFR се повишават (16); противоположните ефекти на кастрацията се наблюдават при многократно приложение на тестостерон (64). По време на кастрацията нивата на EGF намаляват и нивата на TGF-b се повишават, което води до инволюция на простатата. По този начин противоположното действие на тези два пептидни растежни фактора напълно регулира растежа на здрава простата (64, 65).