Сложните протеини съдържат небелтъчни компоненти - Студопедия
Много протеини в състава си, в допълнение към аминокиселините, могат да съдържат непротеинови компоненти. Такива непротеинови съединения в състава на протеините се наричат простетични групи. В зависимост от химичния състав на протетичната група сложните протеини могат да бъдат разделени на няколко класа:
1. Хромопротеини. Това са протеини, чиято простетична група е оцветена. Те включват много протеини, съдържащи метали. Например церулоплазминът, протеин, съдържащ мед, има син цвят. Протеинът, който носи витамин В12, е розов (този витамин съдържа кобалт в състава си). Протеините, съдържащи желязо, са добре проучени: хемоглобин, миоглобин, цитохроми. Червени са на цвят. Наличието на витамин B2 придава на протеините жълт цвят (флавопротеини).
2. Гликопротеини. Това са протеини, чиято простетична група съдържа въглехидрати. Гликопротеините са малка част от протеиново-въглехидратните комплекси, които включват също протеогликани и мукопротеини. Тези протеини играят важна роля в структурната организация на клетките и тъканите, те изпълняват защитни функции. По-голямата част от извънклетъчните протеини са гликопротеини.
3. Липопротеини. Това са протеини, чиято простетична група съдържа липиди. Те осигуряват транспортирането на липиди в кръвта, са компоненти на биологичните мембрани.
4. Металопротеини. Това са протеини, които частично се припокриват с хромопротеините. Тяхната протетична група е представена от метали. Те транспортират или участват в отлагането на метали (феритин, трансферин).
5. Нуклеопротеини. Простетичната група на такива протеини е нуклеиновата киселина. Има дезоксирибонуклеопротеини (простетична група - ДНК) и рибонуклеопротеини(простетична група - РНК). Те играят важна роля в запазването, предаването и внедряването на генетичната информация.
6. Фосфопротеини. Протеините, които съдържат фосфорна киселина в състава си, са популярни в клетката, тъй като процесът на фосфорилиране е начин за повлияване на конформацията на протеина и следователно се използва в системите за регулиране на жизнените процеси.
Протезните групи са свързани с различни видове връзки. Така че за нуклеопротеините е характерна йонна връзка, за гликопротеините и фосфопротеините преобладава ковалентната връзка, за липопротеините - силите на хидрофобно взаимодействие и металопротеините - донорно-акцепторните връзки.
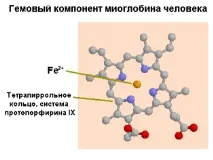
Като пример за особеностите на ролята на структурата в биологичните функции могат да се цитират данни за два протеина - миоглобин и хемоглобин. Те споделят някои структурни и функционални прилики. Миоглобинът и хемоглобинът имат протетична група, наречена хем. Според химичната си структура той е цикличен тетрапирол и придава червен цвят на протеините (фиг. 1.33). Тетрапиролът се състои от 4 пиролови пръстена, свързани в плоска молекула чрез метиленови мостове. Атомът на желязото заема централно място
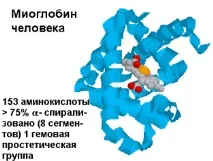 |  |
| Фиг.1.33. Пространствена структура на човешкия миоглобин |
в тази плоска молекула. Има и други протеини с тетрапиролни структури (цитохроми, каталаза и др.). Желязото в хема на цитохромите може да променя своята валентност. Напротив, при хемоглобина и миоглобина промяната на валентността нарушава тяхната функция. Основната функция на тези протеини е свързването на кислорода.
Миоглобинът е сферична молекула 4.5x3.5x2.5 nm, състои се от 153 аминокиселини с общо молекулно тегло 17000. На нивото на вторичната структура той образува 8a-спирални участъци, улавящи почти 75% от всички аминокиселини на молекулата. Атомът на желязото в миоглобиновия хем, който не е свързан с кислорода, излиза от равнината на молекулата с 0,03 nm. В наситената с кислород форма атомът на желязото е сякаш потопен в равнината на молекулата на хема.
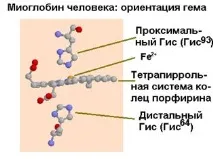 | 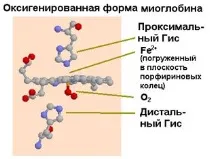 |
| Фиг.1.34. Промяна в ориентацията на хема в резултат на свързване на кислород (вляво - деоксигенирано състояние) |
Образувайки връзка с една от хистидиновите молекули на глобиновата част, желязото, когато се комбинира с кислород, също променя конформацията на протеиновата част. Как може да се обясни фактът, че миоглобинът е удобен за съхранение на кислород, но не е удобен за транспортирането му през кръвта? Отговорът на този въпрос може да се получи, ако се запознаете с графичния израз на процеса на насищане на миоглобина и хемоглобина с кислород в зависимост от парциалното налягане на кислорода.
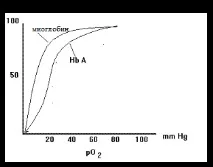 | 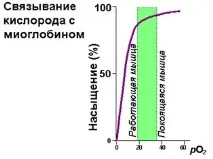 |
| Ориз. 1.35. Разлики в насищането с кислород на миоглобина и хемоглобина в зависимост от парциалното му налягане |
Кривата на насищане на миоглобина с кислород е представена чрез хипербола (фиг. 1.35). В съдовете на белите дробове, където парциалното налягане на кислорода е 100 mm Hg, миоглобинът би бил добре наситен с кислород. Във венозната кръв обаче това налягане е 40 mm Hg, а в мускулите е 20. При такива условия миоглобинът отделя доста малко кислород, така че не би бил достатъчно ефективен при транспортирането на кислород от белите дробове до тъканите. Тази функция се изпълнява успешно от хемоглобина.
За разлика от миоглобина, хемоглобинът е протеин с кватернерна структура. Състои се от 4 двойки еднакви полипептидни вериги. Тези вериги се означават с буквите на гръцката азбука a -, b -, g - и т.н. Тетрамерите на пептидните вериги образуват молекули,
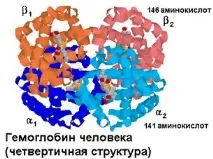
се обозначават с букви от латинската азбука. Основният хемоглобин на възрастен здрав човек се обозначава като Hb A и се състои от две а (141 аминокиселини) и две b (146 аминокиселини) вериги.
Хемоглобинът свързва 4 молекули кислород. Кривата на насищане на хемоглобина с кислород, за разлика от миоглобина, има S-образен характер (фиг. 1.35, вляво). Този тип крива показва, че прикрепването на една кислородна молекула ускорява прикрепването на следващите, което показва кинетиката на кооперативното свързване. Сравнението на зависимостта на насищането от парциалното налягане на кислорода показва, че при частични налягания на кислород, характерни за тъканите, хемоглобинът отделя значителни количества кислород. Това води до заключението, че хемоглобинът е добро средство за транспортиране на кислород и доставянето му на тъканите.
Подобно на промените, отбелязани по-горе при описване на механизма на насищане на миоглобина с кислород, в хемоглобина железният атом също се премества в равнината на хема с едновременна промяна в конформацията на полипептидната верига. Хемоглобинът обаче е протеин с кватернерна структура и отделните му вериги са свързани помежду си. В резултат на това конформационните промени се пренасят в областта на свързване на полипептидните вериги, което от своя страна променя позицията в пространството на цялата молекула и улеснява достъпа на кислород до останалите хеми на молекулата на хемоглобина. В същото време тази промяна
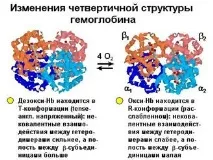
Фиг.1.36. Конформационни промени в хемоглобина в резултат на свързване с кислород
конформацията се придружава от появата на групи на повърхността, които, дисоциирайки, даряват протони на околната среда.
С намаляването на парциалното налягане на кислорода събитията се повтарят, но в обратна посока: кислородът се освобождава попри намаляване на парциалното налягане хемоглобинът преминава в друго конформационно състояние, докато от околната среда (тъкан), където концентрацията на протони е висока, последните се прикрепват към хемоглобина.
Такива конформационни промени позволяват на хемоглобина не само да регулира снабдяването на тъканите с кислород (за повече подробности вижте глава "Ензими"), но и да участва в поддържането на киселинно-алкалния баланс в организма.
Видове човешки хемоглобин. По-долу са основните видове хемоглобин, които се срещат при хората в различни периоди от неговото развитие.
Структурни характеристики на човешкия хемоглобин
| Протеин | Съставът на глобиновата верига | Разпръскване |
| Хемоглобин А (Hb A) | a2b2 | Основният тип хемоглобин при възрастни (95-98%) |
| Хемоглобин A2 (Hb A2) | a2d2 | Малък тип хемоглобин при възрастни (1,5-3,5%) |
| Хемоглобин F (Hb F) | a2g2 | Основният тип хемоглобин в плода; при възрастни - 0,5-1% |
| Hb Хувър-1 | z2e2 | Ембрионален хемоглобин |
| Hb Хувър-2 | a2e2 | Ембрионален хемоглобин |
| Hb Портланд | z2g2 | Ембрионален хемоглобин |
По време на вътреутробното развитие плодът получава кислород от кръвта на майката през плацентата. За да се осигури непрекъснато снабдяване с кислород по този начин, феталната кръв трябва да има по-голям афинитет към кислорода от кръвта на майката. С какви средства се постига това?
Плодът произвеждаHb F, чиято молекула също се състои от четири субединици, две - a и две - g. Най-съществената разлика между g-глобиновата субединица и b-глобиновата субединица е заместването на остатъка с полярназаредена аминокиселина His 143 в b-субединица незаредена аминокиселина Ser в g-субединица. Това води до Hb F с по-нисък афинитет към алостеричния регулатор 2,3-бис-фосфоглицерат (вижте глава "Въглехидратен метаболизъм"), отколкото Hb A. Следователно той има много по-висок афинитет към кислорода.
От друга страна, промените в аминокиселинния състав на глобиновите субединици в резултат на мутации в съответните гени водят до образуването на патологични форми на хемоглобина и развитието на заболявания - хемоглобинопатии.
| Ефект | Хемоглобин | Мутация | Последствия |
| Намален афинитет към кислорода | Hb Канзас | Asn 102 b®Tre | лека цианоза |
| Повишен афинитет към кислорода | Hb Пастир - Буш | Gly 74 b®Asp | Намалено свързване на бис-фосфоглицерат; полицитемия |
| окислен хем | Hb М | Gis 87 a®Tyr | метхемоглобин; цианоза |
| Загуба (в резултат на нарушено свързване) на хема | Hb Хамърсмит | Сушилня 42 b®Ser | Нестабилна b-субединица |
| сърповидни клетки | HbS | Glu 6 b®Val | Хемолитична анемия |
| Дисоциация на димери | Hb Биба | Лей 136 a®Pro | Нестабилен тетрамер |
| Нарушен синтез | Hb Agnan | Вмъкване на TG при кодон 94 - образуване на b-субединица със 156 аминокиселини | Доминираща таласемия, анемия |
Синдромите на таласемия се развиват в резултат на нефункциониращи глобинови гени. В този случай недостатъчният синтез на някоя от субединиците на хемоглобина води до хемолитична анемия. Тежестта на това състояние зависи отброя на гените в една алелна двойка, които са претърпели мутация. Разграничете b-таласемията, при която нивото на b-глобина е намалено. В този случай образуването на Hb F (a2g2) продължава в организма като компенсаторна реакция. а-таласемията се характеризира с намалено ниво на образуване на а-глобин. Това обикновено е по-тежко състояние от b-таласемията. Клинично проявите могат да варират от умерена до тежка анемия до мъртво раждане. Компенсаторно при а-таласемия се образуват Hb H (b4) и хемоглобин на Barth (g4). Трябва да се отбележи, че нито един от тези хемоглобини не е обект на алостерична регулация и ефекта на Бор; и двамата остават в R-конформационно състояние (фиг. 1.36).
Сърповидноклетъчна анемия възниква в резултат на точкова мутация на b-глобиновия ген, който, когато се експресира, води до заместване на Glu с Val в шестата позиция на b-глобиновата полипептидна верига. Следователно, при индивиди с HbS, полярната група на страничната верига на външната повърхност на молекулата се заменя с неполярна хидрофобна група на страничната верига (неконсервативна мутация). Поради хидрофобното взаимодействие между тези неполярни валинови радикали, HbS в своята дезокси конформация полимеризира с други дезокси HbS молекули, което води до утаяване на хемоглобина в еритроцитите. Утаяването на хемоглобина придава на еритроцита сърповидна форма и нестабилност, което води до ускоряване на хемолизата и промяна на еластичните свойства на мембраната, които са необходими при кръвообращението през малки капиляри. Тези червени кръвни клетки причиняват запушване на капилярите.
- При хомозиготи (Hb SS) - тежка сърповидноклетъчна анемия
- При хетерозиготи (Hb AS) - клиничните симптоми са слабо изразени
- Смесена форма на сърповидно-клетъчна анемия и b4-таласемия. При него се наследяват два патологични вида хемоглобин. Захарактеризира се с благоприятни клинични симптоми. Хематологично неговата тежест е обратно пропорционална на количеството на Hb A. Последното може да варира от 3 до 25%.
Основните симптоми на това заболяване са хемолитична анемия и интермитентна болка. Интересното е, че индивидите, хетерозиготни за HbS, са резистентни към маларийния паразит, който прекарва част от жизнения си цикъл в червените кръвни клетки. Това е фактор за подбор на HbS гена в маларийните региони по света.
HbS се отваря чрез гел електрофореза. Липсата на Glu го прави по-малко киселинен от хемоглобин А, така че той не мигрира толкова бързо при електрофореза. Диагнозата е възможна и чрез генно-рекомбинантния метод.
Не намерихте това, което търсихте? Използвайте търсачката: