Същността на редокс процесите
През 1913 г. Л.В. Писаржевски излезе с електронната теория на редокс процесите, която в момента е общоприета. Този тип реакции се осъществяват поради преразпределението на електронната плътност между атомите на реагиращите вещества (пренос на електрони), което се проявява в промяна на степента на окисление.
Реакциите, в резултат на които степента на окисление на атомите, съставляващи реагентите, се променят поради прехвърлянето на електрон между тях, се наричат редокс реакции.
Редокс процесът се състои от 2 елементарни акта или полуреакции: окисление и редукция.
Окислениетое процес на загуба (връщане) на електрони от атом, молекула или йон.Когато се окислява, степента на окисление на частиците се повишава:
Частицата, даряваща електрони, се наричаредуциращ агент.Окислителният продукт на редуциращия агент се нарича неговатаокислена форма:
Редукторът с неговата окислена форма представлява една двойка от редокс системата (Sn 2 +/Sn 4 +).
йонизационният потенциал е мярка за редуциращата способност на даден елементКолкото по-нисък е йонизационният потенциал на даден елемент, толкова по-силен е редуциращ агент, s-елементите и елементите в по-ниско и средно окислително състояние са силни редуциращи агенти. Способността на една частица да отдава електрони (донорна способност) определя нейните редуциращи свойства.
Възстановяване -е процесът на добавяне на електрони към частица.Когато се редуцира, степента на окисление намалява:
Частица (атоми, молекули или йони), която свързва електрони, се наричаокислител.Продуктът от редукция на окислител се нарича неговатаредуциранаформа:
Окислителят с неговата редуцирана форма представлява друга двойка (Fe 3+ /Fe 2+ ) от редокс системата.електронният афинитет е мярка за окислителната способност на частиците.Колкото по-голям е електронният афинитет, т.е. способността на частицата да изтегля електрони, толкова по-силен е окислителят й. Окисляването винаги е придружено от редукция и, обратно, редукцията е свързана с окисление.
Нека разгледаме взаимодействието на FeCl3 с SnCl2. Процесът се състои от две полуреакции:
Редокс реакцията може да бъде представена като комбинация от две конюгирани двойки.
По време на реакциите окислителят се превръща в конюгиран редуциращ агент (редукционен продукт), а редукторът се превръща в конюгиран окислител (продукт на окисление). Те се считат за редокс двойки:
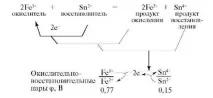
Следователно окислително-редукционните реакции представляват единството на два противоположни процеса на окисление и редукция, които в системите не могат да съществуват един без друг. В това виждаме проявлението на универсалния закон за единството и борбата на противоположностите. Реакцията ще настъпи, ако афинитетът към електрона на окислителя е по-голям от йонизационния потенциал на редуциращия агент. За това се въвежда понятиетоелектроотрицателност -, което характеризира способността на атомите да отдават или приемат електрони.
Съставянето на уравненията на редокс реакциите се извършва по метода на електронния баланс и метода на полуреакциите. Трябва да се предпочита методът на полуреакция. Използването му е свързано с използването на йони, които реално съществуват, ролята на средата е видима. При съставянето на уравнения е необходимо да се установи кое от веществата, които влизат в реакцията, действа като окислител и кое като редуциращ агент,влияние върху хода на реакцията рН на средата и какви са възможните реакционни продукти. Редокс свойства се проявяват от съединения, които съдържат атоми, които имат голям брой валентни електрони с различни енергии. Такива свойства имат съединения на d-елементи (IB, VIIB, VIIIB групи) и p-елементи (VIIA, VIA, VA групи).Съединения, които съдържат елемент в най-високо състояние на окисление, проявяват само окислителни свойства (KMnO4, H2SO4),в по-ниско - само редуциращи свойства (H2S),в междинно - могат да се държат по два начина (Na2SO3). След компилиране на уравненията на полуреакцията, йонното уравнение съставя уравнението на реакцията в молекулярна форма:
Проверка на правилността на уравнението: броят на атомите и зарядите в лявата страна на уравнението трябва да бъде равен на броя на атомите и зарядите в дясната страна на уравнението за всеки елемент.