Съвременната квантова технология в диагностиката и лечението на перспективи за развитие на рак на белия дроб, #10
Каква е същността на фотодинамичната терапия при рак на белия дроб? Какви са ограниченията на този метод на настоящия етап? През последните две десетилетия имаше значителен брой доклади за много успешни клинични приложения на високоенергийни
Каква е същността на фотодинамичната терапия при рак на белия дроб? Какви са ограниченията на този метод на настоящия етап?
През последните две десетилетия се появиха значителен брой доклади за много успешната клинична употреба на високоенергийни лазери при злокачествени белодробни лезии [8]. Като се има предвид факта, че високоенергийният лазерен лъч елиминира обструкцията на дихателните пътища, причинена от тумора, разрешава ателектазата и обструктивната пневмония, подобрява белодробната вентилация, той може да се използва в палиативната терапия на неоперабилни пациенти с рак с обструкция на трахеобронхиалното дърво и като етап на подготовка за операция в комбинация с химиотерапия и лъчетерапия [2].
Ако говорим за съвременните квантови технологии, използвани в онкологията, трябва да се отбележи, че напоследък нискоенергийните технологии придобиха приоритет. Сред тях специално място заемат методите за диагностициране на злокачествени тумори, базирани на ефекта на нискоенергийна индуцирана флуоресценция.
Високата информативност на методите за лазерна флуоресцентна диагностика на живи туморни тъкани се дължи главно на съществуващата връзка между характеристиките на техните спектрални характеристики и функционалното състояние на отделните клетъчни структури, които са част от една биологична система [1].
Най-известният метод в тази посока едиагностика на рак чрез флуоресценция на екзогенни багрила - фотосенсибилизатори (PS), които след предварително приложение се натрупват в злокачествени тумори по определен начин [7].
За съжаление, широкото приложение на този метод в клиничната практика е трудно поради редица причини, включително поради недостатъчната селективност на натрупване в тумори и хетерогенността на химичния състав на тъканите. В допълнение, относително малката дълбочина на проникване в биологичната тъкан на лазерно лъчение с нисък интензитет, използвано за възбуждане на PS флуоресценция, не позволява ефективна диагностика на белодробни неоплазми, локализирани интрамурално (ендофитно растящи тумори и др.).
Според измереното съотношение на интензитета на разсеяната лазерна линия и максималната стойност на интензитета на флуоресценцията се оценява диагностичният контраст (DC), показващ колко пъти интензитетът на флуоресценция на туморната тъкан е по-висок от интензитета на флуоресценция на нормалната лигавица.
където I f.o., I f.n. — интензитет на флуоресценция съответно на тумора и нормалната лигавица;
аз р.о., аз р.н. е интензитетът на разпръснатия лазерен компонент съответно в тумора и нормалната лигавица.
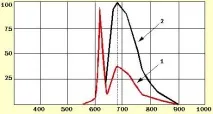 |
| Фигура 1. Схематично представяне на флуоресцентните спектри на нормална лигавица на здрав бял дроб (1) и туморна злокачествена белодробна тъкан (аденокарцином), получени по време на бронхоскопия (2). Флуоресценцията се възбужда с He-Ne лазер (дължина на вълната 633 nm) |
Анкетата се провежда по следния начин. По време на ендоскопия през биопсичния канал на бронхоскопа се вкарва фиброоптичен катетър, който е предназначен да доставя възбуждащо лазерно лъчение.червения диапазон на спектъра към тъканта и едновременно с това регистрира разсеяната лазерна компонента, както и спектъра на флуоресценция, например, когато флуоресценцията се възбужда от He-Ne лазер с мощност 5-15 mW [4] (фиг. 2).
Такъв лазерен спектрален анализ е изключително удобен за оценка на тежестта на ефекта от фотодинамичната терапия (PDT) при рак на белия дроб.
През последните десет години в България и чужбина е натрупан значителен опит в лечението на злокачествени новообразувания на белия дроб по метода на ФДТ. ФДТ на злокачествени новообразувания се основава на катализираното от светлина разрушаване на фотосенсибилизирани тумори (чрез порфирини, хлорини и други багрила, действащи на съответните дължини на вълните) от светлина (източници на лазерно лъчение в IR, видимия и UV диапазона) [9].
Механизмът на смъртта на фоточувствителни туморни клетки под действието на светлина не е напълно известен, но е общоприето, че основният цитотоксичен агент, възникващ от активирането на порфирини от светлина, е синглетният кислород. Установено е, че в резултат на действието на синглетния кислород и продуктите, образувани с негово участие (хидроксилни радикали и пероксиди), възникват дефекти в механизма на транспорта на клетъчната мембрана, нарушава се окислителното фосфорилиране в митохондриите и се развива фотодеструкция на такива биологично важни макромолекули като нуклеинови киселини, протеини и фосфолипиди. Много изследователи смятат, че наред с директната фотоиндуцирана деструкция на туморните клетки, за развитието на класическия фотодинамичен ефект в тъканите трябва да има увреждане на микросъдовете поради увреждане на ендотела в тях.
Лекарствата, използвани като фотосенсибилизатори, в сравнение със здравите тъкани, имат значителна фотодинамична активност идостатъчно висок контраст на натрупване в областите на туморен растеж, достигайки стойности от 2-4 в някои случаи.
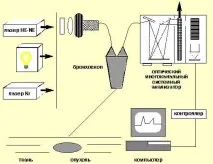 |
| Фигура 2. Схема на лазерен многоканален оптичен бронхоскоп-спектрален анализатор Адаптирано от патент България № 4955489/14 от 25. 06. 90 г. Лощенов В. Б., Кузин М. И., Логинов Л. Е. и др. [4] |
K. S. Zanker и R. Kroczek, изследвайки концепцията, че химическата активност на озона зависи от окислителните свойства (по-точно от реактивните кислородни видове и механизма на окисление на свободните радикали), доказват в експеримент върху култури от злокачествени клетки на бронхопулмоналната система, че озонът, използван в комбинация с химиотерапия с 5-флуороцил в подходяща концентрация, намалява устойчивостта на раковите клетки и повишава терапевтичната ефикасност без повишаване на токсичността [18].
През 1996-1997 г. МС, съвместно с Лабораторията по лазерна биоспектроскопия на GPI RAS, решава проблема за повишаване на терапевтичната ефикасност на PDT при рак на белия дроб, като използва разтвори, озонирани в терапевтични концентрации (озонотерапия) за системно и локално приложение (0,9% физиологичен разтвор, 5% разтвор на глюкоза, разтвор на Рингер, разтвор на Дароу и др.) чрез активиране на фотохимичната реакция, засилване на проникването и натрупването на фотосенсибилизатор и в раковите клетки, повишаване на коефициента на поглъщане на лазерното лъчение от туморната тъкан, което води до значително увеличаване на фотодинамичния ефект [3].
В поредица от експериментални изследвания in vitro върху таргетни клетки беше установено, че озонолизата усилва цитотоксичния фотохимичен ефект на фотосенсибилизатор в биосистема с до 20-30%.
Да се изследва възможността за озон-PDT на злокачествени туморибели дробове с локално приложение на фотосенсибилизатор върху безпородни бели мишки с трансплантиран карцином на Ehrlich (локализация - задна дясна лапа) бяха проведени две серии от експерименти.
В първата серия (основна група) животните в леглото на тумора се инжектират с озониран 0,9% разтвор на натриев хлорид с обем 0,2 ml, където концентрацията на озон е 3,8 μg/ml, и 0,2 ml разтвор, съдържащ алуминиев фталоцианин с концентрация 0,1-0,4 mg/ml и човешки албумин с концентрация 5 mg/ml. Във втората серия (контролна група) се въвежда подобен разтвор на фталоцианин и албумин, но без комбинация с озониран 0,9% разтвор на натриев хлорид.
Експериментални in vivo проучвания показват, че този метод позволява да се постигне по-голямо натрупване и равномерно разпределение на лекарството в тумора, както локално, така и интравенозно.
Озон-PDT методът се провежда по следния начин. Предложеният озониран разтвор се приготвя въз основа на традиционните принципи на озонотерапията. Например, непосредствено преди сесия на PDT, въздушна смес, съдържаща най-малко 1 mg/m3 озон, се инжектира в 0,9% разтвор на натриев хлорид с обем от 200 до 400 ml за интравенозно приложение за 10-20 минути, докато последният достигне концентрация на озон от 3,8 μg/ml. Наситен с озон разтвор на натриев хлорид се прилага интравенозно капково преди или по време на PDT, след приложението на фотосенсибилизатора. След това се извършва ендоскопия на трахеобронхиалното дърво с последователно изследване, за да се установи локализацията на тумора, естеството на неговия растеж и разпространението на придружаващия възпалителен процес. След изследване и аспирация на излишния секрет, лазерно лъчение в червения (или видимия) диапазон на спектъра, например He-Ne-лазер с мощност 5-15 mW, чрез фиброоптичен катетър, свързан с многоканален оптичен спектрален анализатор. В процеса на ендоскопия едновременно се измерва интензитетът на разсейване на облъчената тъкан, използвана за възбуждане на собствената й флуоресценция, и се измерва спектърът на флуоресценция в диапазона от 650–850 nm (при използване на видимо лъчение, в диапазона от 530–650 nm), DC се оценява.
След това през канала за биопсия на бронхоскопа се вкарва фиброоптичен катетър (със сферичен или цилиндричен дифузьор), който е предназначен да провежда терапевтично лазерно лъчение от Kr (647 nm) или Ar (514 nm) лазер. Плътността на мощността на лазерното лъчение по време на PDT сесии варира от 100 до 1600 mW/cm2; енергийна експозиция - от 80 до 600 J/cm2; продължителност на облъчване - от 15 до 30 минути, в зависимост от вида на лазера. След озон-PDT сесията се повтаря флуоресцентно-спектроскопският контрол.
Проблемът за повишаване на терапевтичната ефикасност на PDT се решава най-ефективно със следните характеристики на лекарствата в използваните разтвори: фотосенсибилизатор - 0,005-2,0 mg / kg; озон в разтвор за системно приложение - 3,8 mcg / ml или повече; озон в разтвор за локално приложение - повече от 3,8 mcg / ml.
Клиничните изследвания, проведени в Медицинския център през 1998-1999 г. в областта на използването на електрохимични технологии при лечението на гнойно-възпалителна патология на бронхопулмоналната система, позволяват да се препоръча различен режим на озон-PDT за in vitro и in vivo експерименти. Директно по време на PDT сесията се препоръчва използването на разтвор, например 0,9% разтвор на натриев хлорид с обем от 200 до 400 ml, в режим на постоянно барботиране с озоно-кислородна смес с определена концентрация на озон от 1200 µg/l, което ще дадеспособността да се поддържа постоянна концентрация на озон и свободни радикали през целия сеанс на PDT за постигане на оптимален терапевтичен ефект.
По-нататъшни клинични и експериментални проучвания за оптимизиране на режима на PDT с помощта на химичен фактор на влияние ще определят възможностите както за радикално, така и за палиативно лечение на най-трудната група пациенти с рак на белия дроб, резистентни към известните традиционни методи на терапия.