Корозионно разрушаване на заварени съединения
Когато са в контакт с агресивна среда, заварените съединения по време на работа могат да устоят на металната корозия (корозия) по различни начини. Най-често заварените съединения се подлагат на химическа и електрохимична корозия.
Химическата корозия се нарича корозия, придружена от образуването на химически съединения с метала под прякото въздействие на средата в контакт с него (например сух въздух) без появата на електрически ток.
Пример за химическа корозия е окисляването на желязото във въздуха при нагряване с образуване на оксиди (нагар) на повърхността му или образуването на железен хидроксид в присъствието на дестилирана вода.
Филмите от железни оксиди са крехки, тяхната непрекъснатост се нарушава лесно и желязото (стоманата) продължава да се окислява в дълбочина. Някои метали (алуминий, стомани с високо съдържание на хром и др.) по време на окисляване образуват непрекъснати, издръжливи оксидни филми, които прилепват плътно към повърхността на метала и го предпазват от по-нататъшно окисление.
В същото време оксидните филми върху желязо и стомана, образувани при определени условия (изгаряне в горещи алкални разтвори в присъствието на окислители), също могат да предпазят метала от по-нататъшно окисляване при корозивни условия (например във въздуха).
Електрохимичната корозия се нарича корозия в електролитите, придружена от появата на електрически ток. Електролитите могат да бъдат киселини и техните разтвори, алкали и техните разтвори, разтвори на соли във вода (включително морска вода), както и вода, съдържаща разтворен въздух.
Когато метал се потопи в електролит, положителните йони, разположени на повърхността на метала, ще преминат в разтвор в количество, което зависи от естеството на метала и електролита.Различните метали имат различна разтворимост в електролита, т.е. имат различен електрохимичен потенциал.
Електрохимичният потенциал е стойност, пропорционална на енергията на прехода на метален йон в електролит при дадени условия. Колкото по-отрицателен е електрохимичният потенциал на даден метал в даден електролит при дадени условия, толкова по-лесно той се разтваря в електролита.
Ако два различни метала, свързани заедно, се спуснат в електролит, тогава се образува галванична макродвойка с определена разлика в електрохимичните (електродни) потенциали. В този случай един метал с по-нисък електрохимичен потенциал ще бъде анод, а вторият (с по-висок потенциал) ще бъде катод.
Положителните метални йони (йон-атоми), преминаващи от анода в разтвора (в електролита), придават на разтвора положителен заряд, а излишните електрони, освободени и останали в метала, зареждат анода отрицателно.
Поради излишък от заряди (образуване на електрическо поле) в метала и в електролита възниква електрически ток: електронен в метала и йонен в електролита.
Имайте предвид, че електропроводимостта на течните разтвори (електролити) се дължи на дисоциацията (разпадането) на молекулите на разтвора в йони: положително заредени - катиони и отрицателно заредени - аниони. Под въздействието на електрическо поле катионите (+) се движат в електролита към катода, а анионите (-) се движат към анода и се разреждат.
С възможността за безпрепятствено освобождаване (неутрализиране) на катиони на катода поради електрони, прехвърлени тук, процесът ще продължи непрекъснато.
Поради факта, че материалните частици на метала (йони-атоми) преминават от анода в разтвора, настъпва неговото разрушаване (корозия) - непрекъсната загуба на маса. Вторият метал (катод) в тезиусловия (при наличие на анод) не се разтваря в електролита.
Подобно явление на електрохимична корозия може да се наблюдава, когато метал с двуфазна структура влезе в контакт с електролит.
В случай на различни електрохимични потенциали на структурните фази при условията на контакт на метала с електролита, той ще представлява голям брой галванични микродвойки. Фазовите зърна (или граничните слоеве от зърна), които имат по-отрицателен електроден потенциал, бидейки анод, ще бъдат корозирали в този случай.
Устойчивостта на корозия зависи от химичния състав на стоманата или друг метал, нейната структура, състояние на повърхността, напрежения в нея, химичен състав, концентрация и температура на агресивната среда, както и скоростта на движение на тази среда върху металната повърхност.
В зависимост от работната среда за производството на заварени изделия и конструкции се използват подходящи стомани или други метали (алуминий, титан, техните сплави и др.). Основната задача на заварчиците в този случай е да осигурят еднаква устойчивост на корозия на различни участъци от съединението (шев, зона в близост до заваръчната зона и основния метал встрани от шева).
Чести са случаите, когато в резултат на неправилно избрана технология на заваряване заваръчният метал се оказва по-малко устойчив на корозия от заваряваната стомана.
Така например, ръчно изработени заварки върху нисколегирана хром-силициево-никел-медна стомана от тип SHL (10KhSND) с нисковъглеродни електроди са силно разрушени в морска вода под действието на корозия.
Легирането на заваръчния метал с хром в количество от 0,7–1,0% повишава неговия електрохимичен потенциал и устойчивост на корозия до нивото на основния метал.
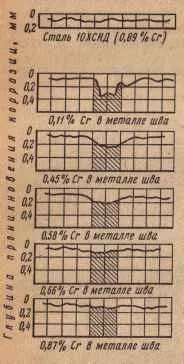
Ориз. 44. Влияние на съдържанието на хром в заваръчния метал върху корозията на заварения шевсъединения от стомана 10ХСНД в морска вода при температура 50°C за 1000 часа.
Таблица 9. Дълбочина на корозия и относителна устойчивост на заваръчния шев в зависимост от съдържанието на хром в него.
Съдържание на хром във връзката, %
Дълбочина на корозия на шева, mm
Относително съпротивление на заваръчния шев (съпротивлението на основния метал се приема равно на 1)